
摘要:近年来‚蛋白质、多肽类药物广泛应用于各类疾病的治疗。本文对聚乙二醇修饰的蛋白质及蛋白质类药物控制释放这两大体系的研究进展做了较系统的总结和评述‚并就更高级的靶向、易吸收的蛋白质药物体系的发展进行了展望。
目前‚肿瘤、艾滋病、肝炎等疾病严重影响着人类健康‚有关方面的药物研究成为药学研究的一个热门领域。其中‚蛋白质、多肽类药物(如肿瘤坏死因子、白介素、胰岛素等)以其疗效好、副作用低等突出优点受到了广大医务工作者及患者的青睐。但与其它合成化学药物相比‚它们也有易引起机体的免疫反应‚体内半衰期短‚在体内易水解、变性‚不易储藏等缺点。另外‚由于多数蛋白质和多肽类药物具有较低的分配系数和很小的扩散性能‚使其不易被亲脂性膜所摄取‚很难通过生物屏障‚因此尽管 DNA 重组技术已使蛋白质、多肽药物可以大量生产‚但由于以上因素从而大大限制了它们在临床上的应用。为此‚研究和开发稳定‚半衰期长‚生物相容性好并且容易吸收的蛋白质、多肽药物体系一直是科学工作者们试图解决的一个迫切课题。目前人们所研究的蛋白质、多肽类药物体系有很多‚各有其优、缺点。
1 通过聚乙二醇修饰蛋白质
1977年‚Abuchowski 等证明:作为治疗药物‚聚乙二醇(polyethlyene glycol‚PEG)修饰的蛋白质比未修饰的更有效。PEG 修饰蛋白质(亦称蛋白质的 PEG 化)主要通过 PEG 与蛋白质的化学结合来实现‚它可增加此类药物的溶解性和稳定性‚减弱免疫原性和毒性‚改善药物的体内药动学性质。
例如:白介素(IL-2)是一个糖基化的淋巴因子‚能促进 T 淋巴细胞增殖‚并激活杀伤细胞‚是目前免疫疗法中重要的细胞因子‚但其水溶性性差‚生物活性不稳定‚且血浆半衰期短‚体内作用时间短而影响了疗效。Katre 等[1] 报道了 PEG 活性酯分子修饰的充足人 IL-2‚其溶解度增加‚血浆半衰期延长‚在 MethA 肉瘤鼠内的抗肿瘤活性也得到增强[2];肿瘤坏死因子α(TNF-α)是一种与炎症发生有关的细胞因子‚对于许多肿瘤细胞都有直接或间接的杀伤作用‚但其体内的清除速度快而且高计量使用时会导致严重的负反应。Tsutsumi 等用琥珀酸酐和 N-羟基琥珀酰亚胺两步活化的 PEG 来修饰 TNF-α‚修饰后 TNF-α的体外生物活性下降而血浆半衰期大大延长。当 TNF-α的赖氨酸侧链氨基酸被 PEG 修饰的程度为56%时‚MPEG-THF-α的体内生物活性比天然 THF-α提高了约100倍[2]。
除了以上两种蛋白质和多肽类药物外‚PEG 修饰的分子还包括色氨酸酶、精氨酸酶、精氨酸脱氨酶、免疫球蛋白 G、神经营养因子、纤维素酶、链激酶等。但 PEG 修饰蛋白质也存在一些问题‚如药物生物活性降低‚某些偶联物在生理条件下不稳定‚蛋白质药物 PEG 化后体内药动学性质的改变可能产生不良反应‚制备过程中某些有毒有机物的使用等。若能妥善的解决这些问题‚蛋白质、多肽药物和 PEG 结合物的给药系统将会得到更为长足的发展
2 通过高分子材料的包覆‚将蛋白质类药物做成可控制释放的微粒
目前,蛋白质和多肽类药物的控制释放体系可分为四大类
水凝胶是指由亲水性的均聚物或共聚物交联而成的聚合物网络。它可在水中溶胀并保持大量水分 而又不溶解并具有良好的生物相容性,因此被广泛应用于蛋白质、多肽类药物的长效释药体系。药物通常采用包埋或吸附的方法固定在水凝胶中。当环境(如:温度,PH 值或离子强度等)改变时,由于溶胀作用,凝胶表面的孔洞变大,水凝胶内外水分扩散途经的打开,药物被释放出去。
pH敏感水凝胶通常是由带阴离子或阳离子单体如丙烯酸(AAc)聚合而成的聚电介质水凝胶。在外界pH发生变化时,由于其大分子上可离子化基团的解离,其平衡溶胀率发生突变,导致聚合物网络中分 子间的孔隙增大或减小,相应的,溶质在凝胶内的扩散速率也发生突变。如徐晖等[4]用聚氧乙烯-聚氧丙稀-聚氧乙烯嵌段共聚物(poloxamer)的甲基丙烯酸衍生物和甲基丙烯酸组成共聚物水凝胶做为载体材料包埋胰岛素,实验证明药物在pH值较低的介质中基本不释放,而在中型或碱性介质中以较快速率释 放,通过改变共聚物中单体的组成可以调节凝胶的平衡溶胀率和凝胶中药物的扩散系数。这类水凝胶的 pH敏感特性使其作为胰岛素口服给药载体成为可能。在胃里,胰岛素基本不释放,聚合物的保护作用减少了药物与胃蛋白酶的接触,避免药物活性受破坏,而在小肠中,药物释放并被吸收。
另外,还有对化学物质(葡萄糖,电介质,抗体等),光,压力等不同环境条件敏感的种种水凝胶,不一 而足。如Ito等人将葡萄糖氧化酶和胰岛素包埋在聚二甲基乙醇胺甲基丙烯酸酯-聚(2-甲基丙烯酸- 2-羟乙酯)共聚物水凝胶中。葡萄糖扩散到凝胶中与葡萄糖氧化酶发生反应生成葡萄糖酸。酸使凝胶中的碱性基团功能团质子化,随着反应进行凝胶中带电位点增多,静电排斥作用使凝胶溶胀,胰岛素就扩散出来。当环境中不存在葡萄糖时,水凝胶则处于不溶胀、不渗透状态。
水凝胶,尤其是环境敏感型的水凝胶做为蛋白质多肽类药物的缓释载体材料,不仅能保护药物,减少药物与蛋白酶的接触机会,避免活性破坏,还因其对特定环境的特殊响应性,在靶向释药和智能型释药方面有着广阔的应用前景。但它也有一定的局限性:1)大部分环境敏感型的水凝胶是不可降解的,不能用 于植入性药物制剂;2)目前环境敏感型的水凝胶的响应性大多较慢;3)由于多数蛋白质、多肽药物脂溶性 差,被释放出来后,仍难以通过消化道的生物膜屏障,因此生物利用度低;目前,新型高分子水凝胶的研究 热点主要集中在从仿生角度出发的多糖和多肽等生物高分子水凝胶的制备与研究上。
脂质体是 60年代由Bangham 在剑桥大学首次发现并命名的。它是由类脂组成的双分子空心球,球 的中心为水性核心,核心外包裹着一层或多层双分子类脂外壳。由于其无毒、可降解、生物相容性很好并 且组分及分子量易于调节,所以用它做为蛋白质、多肽类药物的释药载体近十几年来得到了迅速发展。人们利用不同的材料和组分,采用不同的方法制备了各种脂质体,针对其药物缓释方面的应用进行了大量的研究。
蛋白质、多肽类药物大部分为水溶性,所以多采用两相分散法装载药物。即将类脂物溶于有机溶剂中,然后加入含有包裹药物的水溶液,使油相和水相充分接触,然后将溶剂蒸发成为脂质体药物。
脂质体包裹蛋白质多肽类药物后,不仅可以保护药物,避免蛋白水解酶造成的活性破坏,还能促进透皮吸收,提高生物利用度。脂质体作为治疗内皮网状系统(RES)疾病的药物载体是脂质体最成功的应用 之一。由于脂质体易被内皮网状系统的巨噬细胞所识别,所以富含巨噬细胞的肝、脾是脂质体的重要靶 器官。利用脂质体作为药物载体可直接把药物靶向到这些器官内,从而降低药物的毒副作用。如包裹于 SUV 的 IL-2在增加血液和脾脏白细胞数及激发脾淋巴因子杀伤细胞活性方面的效力明显比游离 IL-2 强[5]。但当脂质体装载治疗其它系统疾病的药物(如抗肿瘤药物)时,因为其易被内皮网状系统识别并且 清除,所以在血液中循环的时间较短,不能满足治疗需要。为此,人们用单唾酸神经节苷脂(GM1)、聚乙二 醇(PEG)或聚乙二醇修饰的磷脂酰乙醇胺(PEG-PE)等修饰脂质体表面。研究表明,经过表面改性的这些 脂质体比传统脂质体被肝、脾的捕捉率降低,且在血液中的循环寿命明显延长。Kim 等[6]以胰岛素为模型药物研究了不同脂质体的药物释放行为,结果发现:未经任何处理的胰岛素直接注入小鼠体内会导致 其因低血糖而死亡,相反,注射了经脂质体包裹的胰岛素的小鼠血糖浓度得到了有效控制,又不致引起大 的副作用,尤其是表面经 PEG 改性后的脂质体胰岛素体系,其突释现象较小且药效时间较长。这显然是 由于 PEG 的引入使得 RES 系统对药物的吞噬作用减弱,体系在血液中循环时间延长导致的 。
目前,脂质体载药技术的发展正日趋成熟。一系列的药物脂质体已进入第三期临床试验阶段,如用于治疗复发性骨肉瘤的含免疫调节剂的脂质体,用于治疗承认呼吸器官窘迫症的前列腺素E1脂质体等。为提高脂质体药物的靶向性,避免作用于正常细胞,温敏性脂质体、pH 敏感脂质体以及表面连接特殊配 体的脂质体正逐渐受到关注。但由于脂质体的热力学不稳定性使得它不能长期保存,而且在载药过程中 有机溶剂的使用也容易造成蛋白质、多肽类药物的失活和变性,因此作为蛋白质、多肽药物的载体还有一定的局限性。

在研究微球给药体系的时候,人们发现当粒子的粒径小于 1μm 时,粒子的释药性能会显现出独特的 优越性。这种粒径小于 1μm 的聚合物微球给药体系被定义为纳米微球给药体系。由于纳米微球的粒径很小,所以它能够穿过上皮组织,通过毛细血管直接进入器官和细胞内部,被更有效地吸收。Panyam[8]等的研究表明当微球的粒径为 100nmm时,其u被小鼠肠内细胞u吸收h的效率是粒径 1~10μme微球的 15~250 cn 倍。因为纳米给药系统具有如此优异的吸收特性,所以近几年来日益受到人们的关注。特别是以 PLGA为载体材料,用 W/O/W 法包裹蛋白质、多肽药物(如胰岛素、生长因子、疫苗等)的研究被广泛报道[8~10]。
纳米粒由于粒径小,进入体循环后,主要被RES中的白细胞、单核细胞以及巨噬细胞吞噬,在这些细胞集中的器官:肝、脾、骨髓中纳米粒尤为集中(5min 内,90%的纳米粒集中在肝,2%~5%集中在脾),这对于治疗这些器官的疾病而言,当然是人们所希望的,但多数疾病病因并不在 RES 系统中,纳米粒在 RES 系统的集中,使得药物在血液中的循环时间很短,到达不了靶器官,不能产生长效缓释作用。因此如何使 纳米粒长循环,靶向非 RES 系统成为了纳米给药系统的研究重点。
巨噬细胞消除外来粒子的主要机制是通过识别结合于微粒上的免疫球蛋白 G(IgG)的 Fc 段和补体, 来吞噬微粒。纳米粒进入体内后,被机体视为异物,抗体和血浆中的多种成分如血浆蛋白、脂蛋白、免疫球蛋白、补体 C 蛋白等吸附到纳米粒上,由于巨噬细胞存在着血液成分的特异受体,纳米粒上吸附的蛋白 或蛋白片段会加剧单核巨噬细胞,尤其是肝脏的枯否细胞(Kupffer Cell)的识别和吞噬。
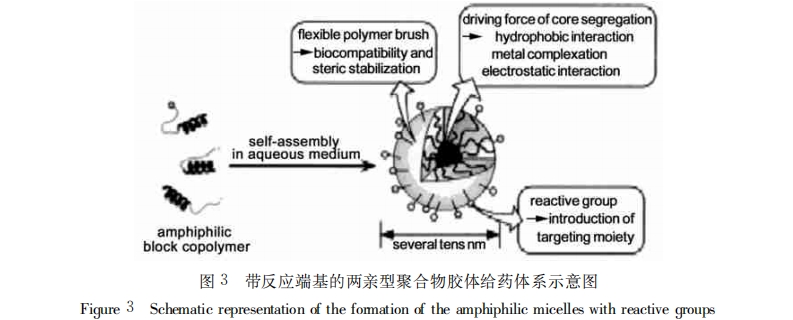
近年来,人们发展了一种新型的聚合物胶体给药体系,它能够改变传统微粒的表面性质,降低巨噬细 胞对粒子的识别性,以达到给药长循环的目的。
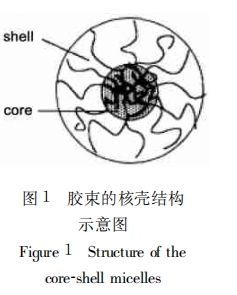
药物被包裹在胶束核心的方式一般有三种:物理缠结、静电力结合和化学 键合。不同方式所采用的载体材料和成球原理各有不同,但由于蛋白质类药物 不稳定、容易失活,所以往往不采用化学键合的方法包裹药物。下面将就物理缠结与静电力结合包裹药物的方法及原理分别叙述如下:
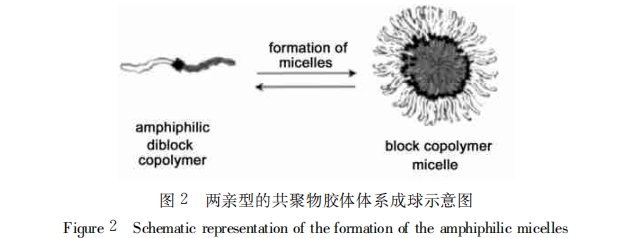
在包裹亲水性的蛋白质、多肽药物时,通常采用双乳液体系,使药物通过与嵌段共聚物中聚酯部分的物理缠结被包裹在核心(一般随胶束表面PEG 密度的减小或内部聚酯分子量的增加,胶束的粒径随之增大)。随着聚酯内核的降解,药物被缓慢释放出来。
由于蛋白质、多肽药物的特殊理化性质,此类药物的口服效果往往很差。胃中酸和消化酶的降解作用以及通过肝的首过作用,都使得药物颗粒难以发挥正常疗效。Tobio 等[13]分别用 PLA 和 PLA-PEG 包裹 破伤风类毒素(TT)得到粒径 150nm 左右的微粒,研究表明在PEG 亲水外壳的保护下,PLA-PEG 微粒在胃液中的稳定性比 PLA微粒高大约 9倍。当给小鼠分别服用包裹 TT 的 PLA-PEG 和 PLA 后可发现,服用 PLA-PEG(TT)的小鼠血液中的TT 浓度较高,持续释放时间较长,说明做为口服给药体系 PLA-PEG 胶体明 显优于PLA 纳米微球给药系统。
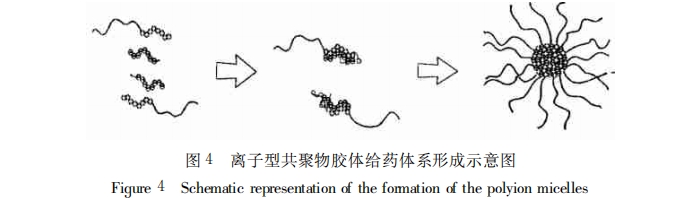
由于离子型聚合物胶体是一种崭新的给药体系,所以在这方面的研究尚不十分全面,并且该体系还 存在着包药量较低、热力学稳定性较差以及不具备主动靶向性等缺点,有待于进一步的研究和改进。
3 结论与展望
综上所述,在过去的二、三十年中人们对蛋白质、多肽药物进行了大量的改性和释药研究。较理想的 蛋白质、多肽类药物给药体系应:(1)能最大限度的保持药物的生物活性,制备过程安全无毒;(2)有良好的生物通透性,能穿过体内生物屏障达到病变部位;(3)有抗巨噬细胞吞噬能力,在体内能长循环,生物利 用度高;(4)具有靶向性,即对病变细胞或组织具有特异性的识别和靶向性;
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。