
摘要:肝脏疾病是威胁人类生命健康的重要疾病之一,对肝脏疾病检测及治疗方法的研究也引起人们的极大重视。靶向药物递送系统(TDDS)可将药物选择性地输送到靶点组织,从而提高药物的生物利用率并降低毒副作用,已引起了研究者的广泛关注。近年来,越来越多的研究尝试将靶向药物递送系统应用于肝脏疾病的显像检测以及药物/基因治疗,并取得了十分显著的成绩。本文将对近年来开发的新型纳米肝靶向给药系统,尤其是配体-受体介导的主动肝靶向给药系统在药物/基因递送以及显影检测方面的最新进展做一个综述,对各靶向给药系统的肝靶向能力进行了总结对比,并对肝靶向给药系统的发展方向进行了预测。
我国是世界上肝脏疾病的高发区,其中乙肝感染者数量已经过亿,相当于每10个人中即有1个乙肝感染者,丙肝病毒感染者也已超千万大关,而乙型丙型病毒是导致肝硬化、甚至肝癌的重要因素[1] 。全国每年超过100万人死于病毒性肝炎等相关疾病,而因肝癌死亡的人数即超过10万人,在男性中占据癌症死亡人数的第3位,女性中居第4位。
目前,对于病毒性肝炎、肝硬化、肝纤维化等疾病仍以药物控制为主。而对于早期肝癌患者来说(瘤块 小于5cm),其癌细胞并未扩散到淋巴结和身体的其它部位,因此手术切除治疗是最为有效手段。然而肝癌 的发病较隐匿,早期患者无明显症状,而肝癌患者一旦因出现症状而前往医院就诊,其病程大多已进入中、晚期,错过了手术治疗的最佳时期;此时即使手术切除,其治疗成功率也仅为20%~30%[2,3] 。由此可见,实 现肝癌的早期高灵敏检测是手术治疗能否成功的关键因素,这对于显像学的发展提出来更高的要求;而对 于肝炎、肝硬化以及中晚期肝癌患者:非手术治疗,尤其是药物治疗就成为了综合治疗的重要手段之一。
化疗是利用化学药物对癌细胞产生杀伤作用,同时也可控制癌细胞扩散。目前,化疗是治疗肝癌的最普遍采用方法,但传统的化疗方式是通过常规途径给药,当达到一定的血药浓度后,化疗药物在全身分布,缺乏选择性,在杀伤癌细胞的同时也对全身脏器构成伤害,不仅影响疗效,也给病人带来巨大痛苦;且到达肝脏肿瘤部位的药物仅为一小部分,大部分药物不仅未发挥药效作用,还会对其它正常脏器产生严重的毒副作用,影响这些药物的治疗效果。因此,改变化疗的给药途径、变换药物剂型等各种各样的尝试从未间断,其中肝靶向性纳米给药系统的研究已引起越来越多的重视。
肝靶向药物递送系统(Liver targeted drug delivery system,LTDDS)可将药物、基因等化学物质选择性地输送至肝脏,提高负载物在肝脏部位的浓度、延长其半衰期,从而达到减少用药剂量和给药次数,降低药物毒副作用,提高转染效率。随着对细胞表面结构功能认识的不断深入,近年来受体介导的肝靶向递送系统成为研究热点[4,5] 。它是采用物理或化学的方法将特定的配基引入药物载体,通过配基与细胞膜上的受体发生特异相互作用,介导细胞实现对修饰有配基的载体材料的高效内吞,从而达到靶向递送的目的。另外,利用LTDDS还可将显影剂高浓度的富集于肝脏部位,提高显影效果,从而达到提高检查灵敏度的作用。由此可见,开发高效的LTDDS对于肝脏疾病的早期检测以及治疗均有非常重要的作用。而纳米技术近30年来发展迅速,利用纳米尺度的脂质体、胶束、微凝胶等作为载体可以起到促进药物溶解、提高药物稳定性、改善药物释放行为等功效;更重要的是纳米技术还可以改变药物在体内的分布,即具备一定靶向能力。因此,将纳米技术与靶向递送系统相结合,开发新型的肝靶向性纳米给药系统成为了今年来研究的热点。本文中将对目前开发的主/被动肝靶向给药系统进行综述,并对各靶向给药系统的肝靶向能力进行对比总结。
1 被动靶向
被动靶向(passive targeted),指的是载药微粒进入体内后由于肿瘤与正常组织间血管密度及渗透性的差异或被巨噬细胞作为外界异物吞噬的自然倾向而产生的体内分布特征。一般认为:被动靶向的微粒经静脉注射后其在体内的分布首先取决于粒径的大小,小于100nm的纳米囊或纳米球可缓慢积集于骨髓;100~200nm的纳米粒子可富集于实体肿瘤部位;0.2~3μm时一般被肝、脾中巨噬细胞摄取;大于7μm的微粒通常被肺毛细血管床截留,进入肺组织或肺气泡[6] 。由此可见被动肝靶向给药体统主要依赖于体内的单核吞噬细胞系统(mononuclear phagocytic system,MPS);早期文献中也将MPS称为网状内皮系统(reticulo-endothelial system, RES)。
单核细胞发生于骨髓的多能干细胞,循环于血液中,是血液中最大的血细胞。目前认为单核细胞是吞噬细胞的前身,它穿透血管内皮进入组织内,转变为吞噬细胞。肝脏拥有人体内数量最多的吞噬细胞——枯否细胞(KCs),约占吞噬细胞总数的80%。研究表明具有以下特征的颗粒会被MPS迅速清除并在肝、脾等器官累积,从而产生一定被动靶向功效:(1)拥有较大的粒径(直径>200nm);(2)非球形颗粒;(3)表面具有较强疏水性;(4)表面具有高密度电荷[7] 。因此利用MPS吞噬功能就成为了肝靶向给药的有效途径。Chiannilkulchai等将负载阿霉素的聚氰基丙烯酸异己酯(PIHCA)纳米颗粒(npc-DXR,粒径250nm)用于小鼠转移性肝肿瘤的治疗[8,9] 。结果发现,相对阿霉素注射液(f-DXR),npc-DXR可明显增加阿霉素在肝脏部位的富集,其肝肿瘤药时曲线下面积(AUC0~48h)是对照组的2.53倍;因此其抑制肝肿瘤转移能力远远高于f-DXR(两者肿瘤转移率最大相差82%),从而大大延长了小鼠的存活时间。
虽然MPS靶向对于治疗肝肿瘤具有一定的促进作用,但众所周知,恶性肝肿瘤往往发生在肝实质细胞,而MPS会将大量药物聚集在KCs细胞中,这就造成大量药物无法直接作用于肿瘤部位,影响治疗效果。因此,开发肝实质细胞靶向给药系统就显得尤为重要。不过我们也应注意到:KCs与肝部炎症以及肝纤维化有着重要联系,因此在治疗此类疾病时,MPS的被动靶向作用仍然具有十分重要的作用。
2 主动靶向
为了降低MPS系统对主动靶向效率的影响,首先应保证药物载体能逃离MPS的吞噬,并实现在血液内的长效循环。因此,一般均需对纳米粒子表面进行亲水改性并控制其粒径在100~200nm之间(亦有文献报道为50~150nm)[10] 。由于PEG具有高亲水性、高体积排阻效应以及低毒性,已经成为目前最常用的亲水改性试剂。
按肝靶向的靶细胞分类 , 肝靶向递送系统可分为肝实质细胞靶向 、非实质细胞靶向以及肝肿瘤细胞 靶向 , 下文中将分别对这几种肝靶向给药系统进行详细介绍 。
肝实质细胞(hepatic parenchymal cells, HPCs)是肝脏中数量最多的细胞,约占肝脏总细胞数的60%~70%[11] 。有关肝的大多数病变如肝癌、肝炎、肝硬化等多发生于此,是肝靶向给药系统理想的靶标之一。肝实质细胞表面含有多种受体,如去唾液酸糖蛋白受体可以识别半乳糖、乳糖等配体;甘草酸/甘草次酸受体可以识别甘草酸以及甘草次酸等。利用这些受体-配体间特异性的相互作用,研究人员研发出一系列高效的肝靶向给药系统。
2.1.1 去唾液酸糖蛋白受体介导的肝靶向给药系统 目前受体-配体介导的肝靶向给药系统研究中,应 用最为广泛的是去唾液酸糖蛋白受体(asialoglycoprotein receptor, ASGPR)。ASGPR又名肝凝集素 (liver lectin)和肝细胞半乳糖受体,是20世纪六七十年代由Ashwell和Morell[12] 在研究哺乳动物血浆 糖蛋白代谢时发现的一种受体,其在不同种属的哺乳动物肝细胞上的数量不同:如鼠肝细胞上含有 500,000个ASGPR受体[13] ,人肝细胞上含有225,000个ASGPR受体,其中约87%分布在肝实质细胞膜 表面[14] 。ASGPR是现今为止了解得最透彻的肝主动靶向受体,它能专一识别末端带有半乳糖(Gal)残 基或乙酰半乳糖胺(GalNAc)残基的寡糖或寡糖蛋白,目前已见报导的ASGPR配基有:去唾液糖蛋白、乳糖酸(lactoBioni cacid, LA)、半乳糖化配体(galactosylated ligand,Gal)、无唾液酸胎球蛋白(AF)以及 豆甾醇糖苷(soyBean-derived sterylglucoside,SG)等。
Wu等[16]将去唾液酸胎球蛋白(AF)修饰到脂质体表面(AF-L),并研究了其在小鼠体内的分布及对肝实质细胞的靶向能力,结果显示:14C标记的AF-L在肝脏累计可达73%,而非AF标记的脂质体在肝脏的累计仅为16.5%。Cai等[17] 将干扰素(IFN)与半乳糖化的人血清白蛋白(HAS)共价连接得到偶合物Gal- HSA-IFN,并用125I对偶合物进行标记。结果显示肝细胞与Gal-HSA-IFN(89.53%)的结合率较HSA-IFN(6.66%)明显提高。小鼠体内分布研究表明Gal-HSA-IFN具有明显趋肝性(肝脏分布>45%/g)。

Jeong等[23]通过阴离子开环聚合法得到半乳糖修饰的聚乙二醇-聚谷氨酸苄酯嵌段共聚物(LA-PEG-PBLG),其可在水溶液中组装成50~300nm的胶束。作者通过流式细胞仪比较了不同种类肝癌细胞对荧光标记纳米粒的摄取能力,结果显示HepG2细胞(富含ASGPR受体的肝癌细胞株)内的荧光强度要远高于SK-Hep01细胞(ASGPR受体缺失的肝癌细胞株),说明ASGPR受体具有专一性。
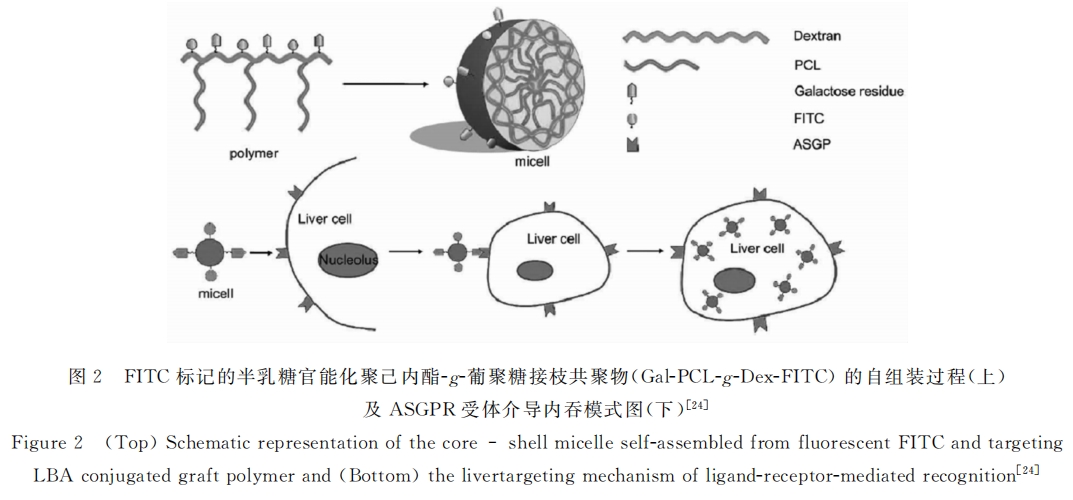

另外,Maitani课题组[26]开发了一类基于豆源甾醇糖苷(SG)的肝靶向给药体系。他们将SG链接到脂质体表面,并将其用于包载阿霉素(DOX)。其研究结果显示,相比普通脂质体SG修饰脂质体可将更多的药物输送至肝实质细胞,而SG与肝实质细胞间的结合可以被去唾液酸胎球蛋白(AF)抑制,体现出其ASGPR受体介导的性质[27] 。石靖等[28]也制备了豆甾醇糖苷修饰阳离子脂质体(SG/PEG-CL),并研究了其在小鼠体内的分布及对肝实质细胞的靶向能力,结果显示:尾静脉注射SG/PEG-CL半小时后,其在肝脏的累计达到峰值(75%),而且显示出明显的肝实质细胞靶向能力(其在实质细胞中的浓度约为非实质细胞中的2.9倍)。
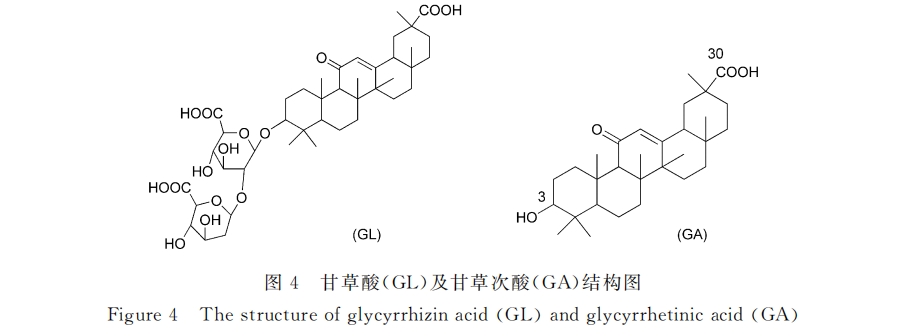
甘草酸受体
甘草次酸受体
在Negishi研究中发现[31] :甘草次酸与肝细胞的结合能力远远大于甘草酸,因此,以甘草次酸作为肝靶向配体有望获得更为优异的靶向功能。毛声俊、侯世详[39]最早研究了此类肝靶向载体,他们以混合类脂(磷脂、胆固醇)为载体,制备了甘草次酸修饰的载钙黄绿素脂质体(Cal-LP-GA),并研究了其对鼠源细胞的亲和能力。大鼠肝细胞内吞实验显示:鼠肝细胞对Cal-LP-GA的摄取量是普通脂质体的3.3倍,并且游离甘草次酸能显著的抑制该过程,而对照组几乎不受影响,证实了甘草次酸受体介导的肝靶向能力。
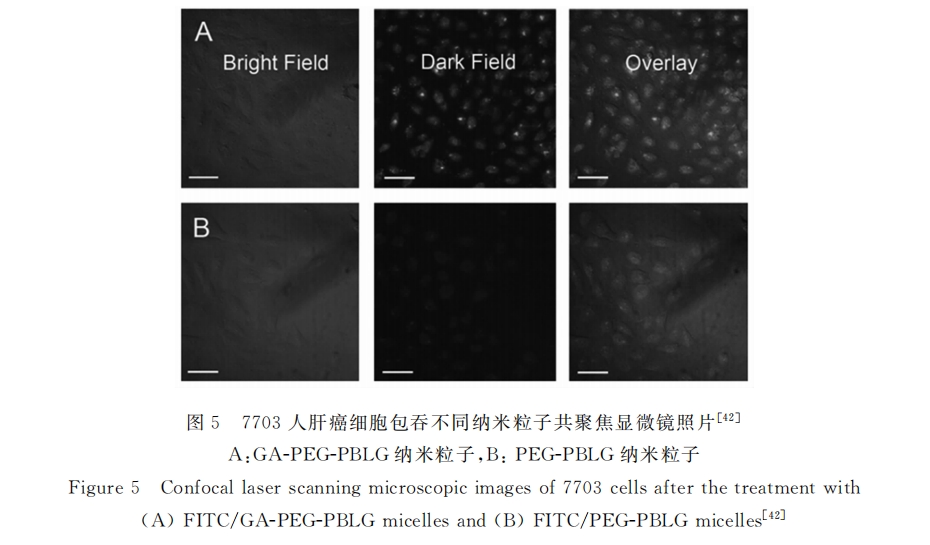
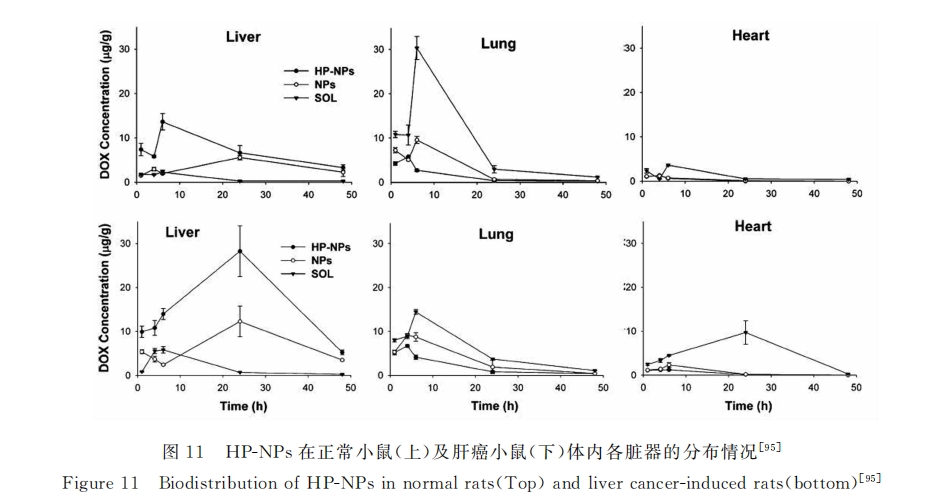
为了研究甘草次酸受体介导肝靶向给药体系对药物代谢的影响。张闯年等[47]制备了甘草次酸修饰海藻酸钠载阿霉素纳米粒子(DOX/GA-ALGNPs),并考察了肝靶向给药体系的药代动力学。研究结果显示:尾静脉注射3h后(7mg/kg)小鼠肝脏药物浓度达到峰值(67.8μg/g),是非靶向纳米粒子组峰值药物浓度的2.8倍;此外,相对阿霉素盐酸盐(DOX●HCl)注射液,靶向组药物在肝脏的平均驻留时间(MRT)及半衰期显著上升,分别是DOX●HCl的9.7倍和3.8倍,即使在注射药物4天后,肝脏中仍可检测到较高浓度的阿霉素(26.7μg/g)。由此可知DOX/GA-ALGNPs不仅可以促进药物在肝脏的富集,而且延长了药物在肝脏部位的驻留时间,显著提高了药物的生物利用率。
本组前期研究中发现:包载阿霉素的GA-PEG/CTS复合纳米粒能显著抑制异位肝癌荷瘤裸鼠的肿瘤生长。但众所周知,肝脏是人体重要的代谢器官,其发生病变后,人体环境会发生很大改变。因此,在原位肝肿瘤模型条件下研究肝靶向给药体系的效果就显得尤为重要。张闯年等首先建立了原位肝肿瘤荷瘤小鼠模型,并在此基础上研究了DOX/GA-ALGNPs的对原位肿瘤的抑制效果[47] 。结果显示:DOX/GA-ALGNPs对于原位肝肿瘤抑瘤率可达76.6%(wt),而相同给药条件下的DOX●HCl抑瘤率为52.6%(wt);同时,我们发现注射DOX●HCl组小鼠心肌细胞有坏死现象且体重有显著下降,而靶向组小鼠心肌细胞正常且体重无明显变化。结合以上结果可知,由于DOX/GA-ALGNPs可将药物集中输送到肝脏部位并减少其在其它脏器的分布(如心脏),因此其不仅可显著提高其肝肿瘤抑制能力,而且明显降低药物的毒副作用。
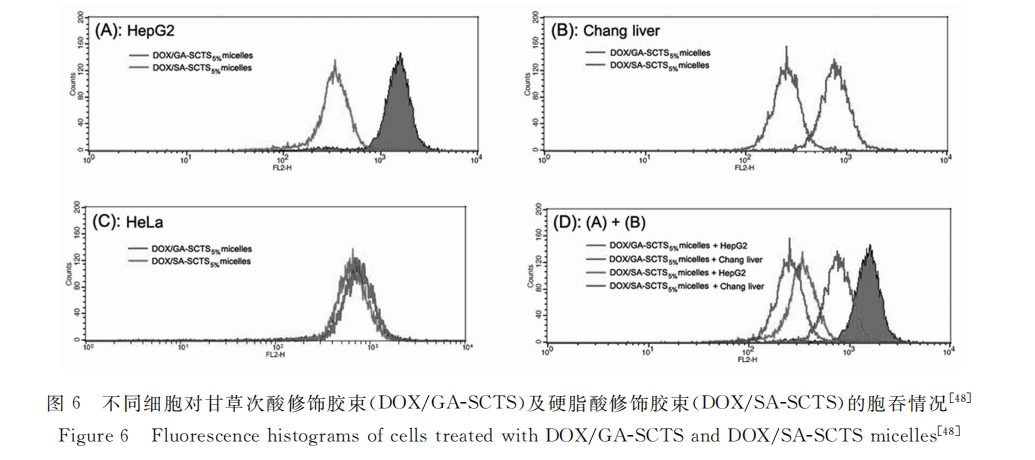
综上所述,这些结果不仅进一步阐明了肝细胞表面存在甘草类物质的受体,也证实了甘草酸/甘草次酸受体介导的肝靶向给药的可能性。与去唾液酸糖蛋白受体一样,甘草酸/甘草次酸介导的靶向给药系统主要用于肝实质细胞给药,而且,甘草酸/甘草次酸介导的靶向给药系统可在原位肝肿瘤模型中发挥优异的治疗效果,具有十分良好的应用前景。但该靶向给药系统还有许多待解决的问题,特别是甘草酸/甘草次酸的受体仍未确定,且配体-受体间相互作用机理也还需进一步阐明。
陈志鹏等[50]制备了胆酸修饰脂质体(BP2BL)并研究了其肝靶向能力,结果显示与传统脂质体(CL) 相比BP2BL的血液循环时间及肝脏驻留时间均显著延长,其在肝脏的药时曲线下面积值(AUC)是CL的1.45倍,体现出一定的肝靶向能力。但研究显示,该给药体系并未提高药物在肝脏的峰值浓度。
2.1.4 清道夫受体介导的靶向给药系统 清道夫受体(Scavenger receptor,SR)是固有免疫中一类重要的模式识别受体,分为多种类型(SRA、SRB),其中SRB主要分布于肝脏部位,参与脂肪、胆固醇转运等体内过程。高密度脂蛋白(HDL)的主要功能是清除血液和细胞中过多的胆固醇,它可将沉积在血管壁的胆固醇、血小板颗粒剥离下来,然后通过与肝细胞表面SRB的高亲和性结合将胆固醇带入肝脏,经胆道-肠道排出体外,因此HDL具有一定的肝细胞靶向功能。
表1中对靶向肝实质细胞的给药系统进行了总结,从表中可见ASGPR肝靶向给药系统拥有很高的肝靶向能力,其介导给药体系在肝脏的富集率达到了50%~80%。然而,有研究表明ASGPR的密度和结合活性会随许多生理和病理条件的变化而发生改变,并且大多数肝脏疾病患者的血清中均存在结合抑制剂,可能会导致ASGPR结合活性的降低,使其对半乳糖配基的特异性识别作用减弱[53,54] ,因此其在病变模型体内的肝靶向能力还有待进一步的实验验证。甘草酸/甘草次酸修饰的肝靶向给药系统也具有非常强的趋肝性,其与ASGPR体系的肝靶向能力相当或略有优势(42%~87%)。另外研究表明:GA介导的肝靶向体系具有肝癌细胞特异选择性,这对于开发新型肝癌诊断显影剂及降低药物对正常肝组织的伤害都具有十分积极的作用。
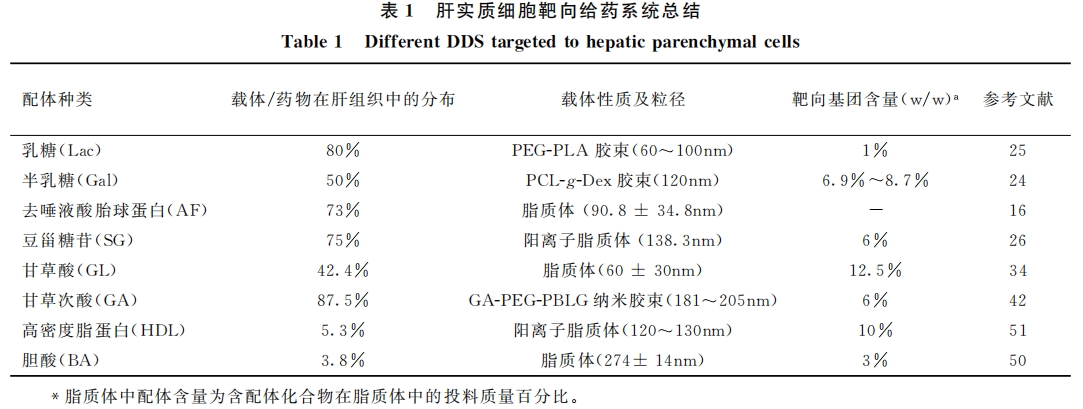
另外,人们曾对胆酸及清道夫受体介导的肝靶向给药系统寄予厚望,也很多文献表明它们与肝实质细胞有较强的结合,但其在体内并没有体现出优异的肝靶向能力(肝富集率<10%)[55] 。造成这种情况的主要原因是:虽然胆酸及HDL主要参与肝脏部位的物质转运,然而无法在肝脏长时间驻留,从而它们影响了药物在肝脏的积累,因此也有研究者将乳糖/半乳糖等修饰在其表面进行改性以提高其趋肝性[56,57]。
肝脏中除了实质细胞外还有30%左右的非实质细胞,它们在肝脏中也起着重要的作用。肝脏中的非实质细胞主要包括枯否细胞(Kupffer cells, KCs)、肝窦内皮细胞(sinusoidal endothelial cells, SECs)以及肝星状细胞(hepatic stellate cells, HSCs)等。其中KCs是具有吞噬能力的巨噬细胞,约占肝细胞总量的15%,是吞噬系统中数量最多的细胞(约占80%);研究表明KCs与肝部炎症发生以及肝纤维化均有重要联系。而HSCs在肝脏受到炎症或机械刺激等损伤时会被激活,并通过增生和分泌细胞外基质参与肝纤维化的形成和肝内结构的重建[58] 。SECs则在几种急慢性肝病的发病机理中均起到重要作用,目前主要作为抗肝炎药物的靶标[59] 。因此,对肝非实质细胞靶向给药系统的研究对于治疗肝炎、肝纤维化及肝硬化等急/慢性疾病有着重要的意义。本文将主要对近五年来非实质细胞肝靶向药物递送系统的最新进展进行综述并对其肝靶向性能进行对比。
2.2.1 甘露糖受体介导的肝靶向给药系统 甘露糖受体(mannose receptor, MR)是分子量为175,000的跨膜蛋白,能与含有甘露糖配基的物质特异性识别结合,广泛存在于肝KCs 细胞表面[60,61] 。BijsterBosh等[62]将甘露糖修饰的葡萄脑苷酯酶经鼠尾静脉注射,10min后检测到材料在肝脏的富集率 为65.6%。
Hirata等[61]制备了不同程度甘露糖化的人血清白蛋白突变体(Man-rHSAs: D63N, A320T and D494N),以及他们的三倍体(TM-rHSA: D63N/A320T/D494N),并通过111In标记法检测了其在动物体内的分布情况。结果显示:各HAS突变体均可迅速从血液中清除并累计到肝脏,其清除速率与甘露糖化程度成正相关,而且近90%的TM-rHSA被肝非实质细胞胞吞。接下来作者又考察了TM-rHSA在不同非实质细胞(KCs细胞及SECs细胞)中的分布,结果表明125I标记的TM-rHSA几乎完全与KCs细胞结合,而很少与SECs细胞结合,表明甘露糖受体主要分布于KCs细胞表面。
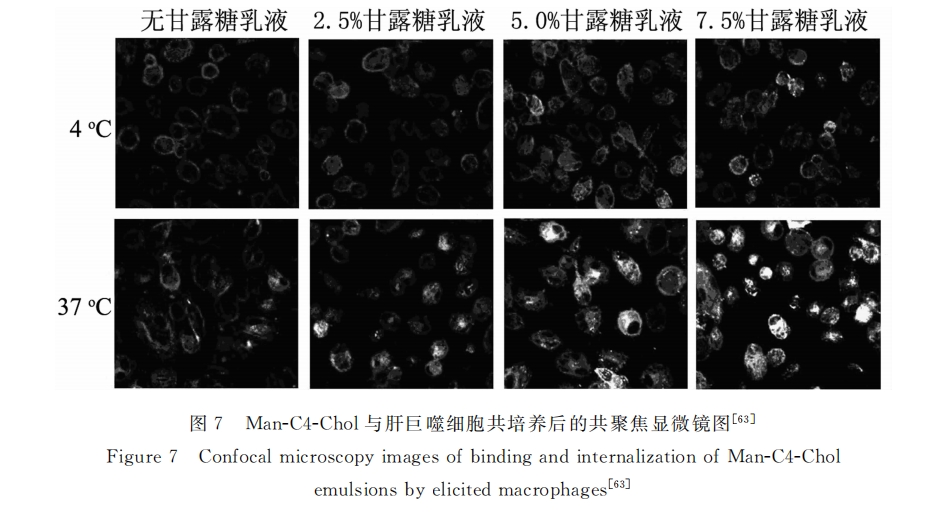
如Yang等[66] 以pH敏感多肽GFLG为连接臂将M6P键连到聚羟丙基甲基丙烯酰胺(PHEMA) 上,并负载I型胶原特异三倍体寡核苷酸(M6P-GFLG-HPMA-GFLG-32P-TFO)用于肝纤维化的治疗。结果显示:M6P-GFLG-HPMA-GFLG-32P-TFO可迅速被肝脏吸收,而其中有80%是被肝星形细胞包 吞,表明M6P/IGFII受体介导在此过程中起到了重要作用。Prakash等[67]将多价M6P及抗癌药物阿霉 素同时修饰到人血清白蛋白上(Dox-HSA-M6P28)并将其用于肿瘤治疗。体内分布结果显示,有近50% 的Dox-HSA-M6P聚集在肝脏。
2.2.3 IV 型胶原受体介导的靶向给药系统 肝纤维化患者的肝星形细胞表面,VI型胶原受体表达上调[68] ,而IV型胶原中最主要的作用位点即为RGD短肽序列。因此,利用RGD作为靶向基团的载体即成为肝肿瘤药物载体研究的一个新方向。
Beljaars等[68]首次将含RGD片断的环肽(C* GRGDSPC* ),两端半胱氨酸以二硫键相连)修饰到人 血清白蛋白表面(pCVI-HSA),并考察了其在肝纤维化动物模型中的应用。结果显示有73%的pCVI- HSA富集于纤维化肝脏;体外实验也表明pCVI-HSA的趋肝性来源于其与HSCs细胞的特异性结合。此后,王吉耀课题组又对此体系进行了改进, 他们将环肽中的一个半胱氨酸更换为赖氨酸 (C* GRGDSPK* ),从而用酰胺键代替双硫键制备环RGD多肽,大大提高了环肽的体内稳定性[69,70] 。
2.2.4 透明质酸受体介导的靶向给药系统 透明质酸(HA)是一种大分子糖胺聚糖,是构成细胞外基质和细胞间质的主要成分。细胞膜表面有多种 HA受体,包括CD分化群(Cluster determinant44, CD44)、肝内皮细胞受体(receptor-mediated endocytosis to liver endothelial cells, LEC)、细胞内吞HA受体(HA receptor for endocytosis, HARE)、HA介导的游动性受体(receptor for hyaluronate-mediated motility, RHAMM)和淋巴管内皮特异性HA受体(lymphatic vessel endothelialhyaluronan receptor-1, (LYVE-1)等[71] 。其中,CD44在肿瘤细胞表面高表达,LEC主要存在于肝内皮细胞,HARE主要存在于肝星形细胞内,因此,HA在肝靶向给药体系中具有重要的位置。
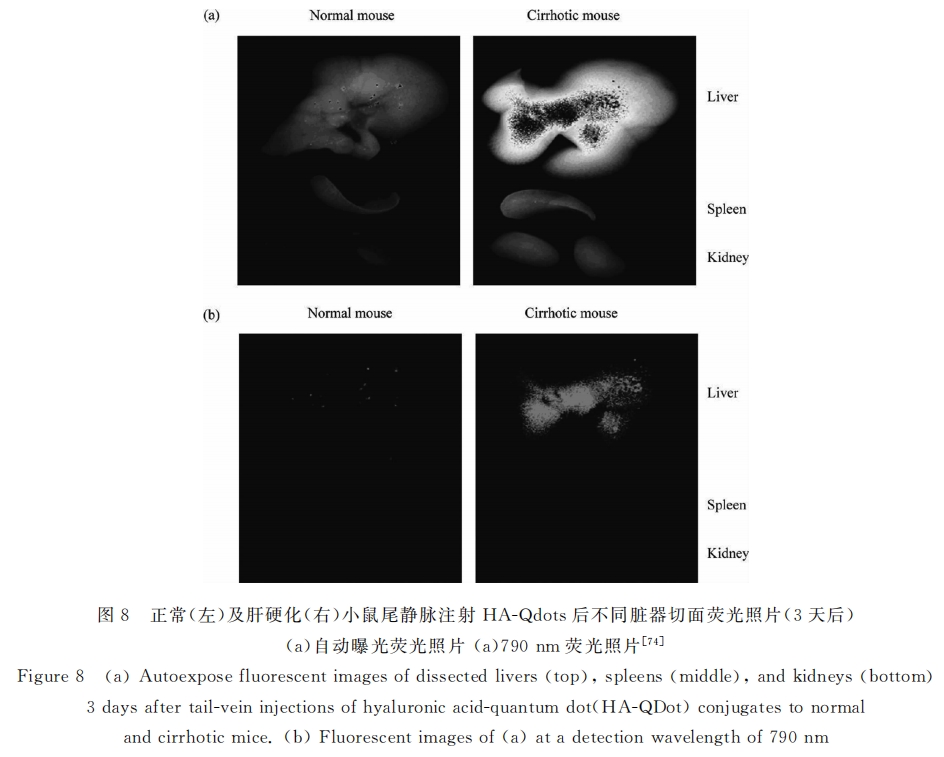
Ohya等[72] 研究发现,HA包覆的聚赖氨酸-聚乳酸胶束对人肝窦内皮细胞具有明显选择性;ToriyaBe等[73]也发现HA修饰的脂质体可被肝窦内皮细胞吞噬并在肝脏显著聚集,此肝聚集现象可被游离HA抑制,且其聚集程度随脂质体表面HA含量增加而增加。
2.2.5 血小板生长因子受体-β介导肝靶向给药系统 血小板生长因子受体(platete derived growth fact receptor,PDGFR)是一种跨膜糖蛋白,具有酪氨酸蛋白激酶活性。PDGFR由两种亚单位α及β构成,其分子量为170~180KD。二者与血小板生长因子(PDGF)结合力相差很大,α亚单位与PDGF-A链及PDGF-B链有较高的亲和力,而β亚单位仅与PDGF-B链有高亲和力。静止的HSCs表面只有α亚单位,HSC活化后才表达β亚单位,而且以β亚单位为主。因此,在动物和人肝纤维化时,肝组织中PDGFR-β表达明显增加,并与HSC数量和肝纤维化程度显著相关[76] 。利用激活HSCs表面PDGFR-β高表达的特性,研究者开发了一系列肝靶向给药系统治疗肝纤维化疾病。

表2中对不同配体介导的非实质细胞靶向给药系统进行了总结,从表中可见:甘露糖、M6P以及靶向IV胶原受体的RGD环肽对肝脏的靶向能力较强(肝累积率一般在60%~70%),而HA以及靶向PDGF受体的PPB环肽的肝靶向能力相对较弱(50%以下)。这与配体的修饰密度虽然也有一定关系,但总体上来看影响并不明显。对于M6P、RGD环肽以及PPB环肽介导给药系统来说,其相应受体均分布于HSCs,且在正常条件下低表达而在肝损伤的条件下高表达。因此虽然肝脏的病变对其在肝脏部位总体的富集程度没有影响,但这些受体介导的给药系统对靶细胞的靶向能力仍体现出了明显的肝损伤依赖性,即只在肝纤维化情况下才对靶细胞产生显著的靶向作用。由于大多数肝病患者体内环境都会出现一定程度的改变,因此这种肝损伤依赖的靶向性对于肝脏疾病的治疗具有十分积极的意义。此外,这种性质对于肝纤维化/肝硬化的诊断同样具有十分重要的作用,我们可以通过靶向载体在肝脏中的分布情况来判断是否出现病变。
2.3.1 抗体介导的肝靶向给药系统 单克隆抗体(monoclonal antiBodY, mAB),简称单抗 , 是仅由一种类型的细胞制造出来的抗体。单克隆抗体以其特异性强、纯度高、均一性好等优点,已广泛应用于生物医用领域。单抗可与放射性同位素、化疗药物及毒素等,结合形成免疫偶联物(immunoconjugate),是目前肝脏疾病的治疗途径之一。常选用的放射性核素有131I、125I、188Re、99mTc等,以131I最为常用。2006年,由成都华神集团与第四军医大学的陈志南课题组共同研制的[131I]2美妥惜单抗注射液获得国家食品药品监督管理局颁发的生产文号(商业名:利卡汀)。制剂所选用的肝癌单抗美妥惜与肝癌细胞表面的HAB18G/CD147抗原具有较强亲和力,其引导131I发射高能β粒子并杀伤肝癌细胞[80,81] 。这是目前全球唯一一个用于治疗原发性肝癌的靶向药物,也是我国具有自主知识产权的抗体类药物。
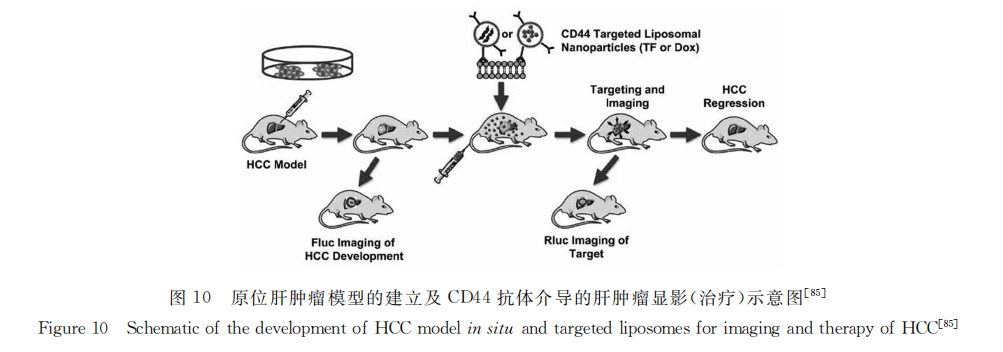
此外,将单抗与纳米载体材料连接,可赋予微粒对靶细胞分子水平上的识别能力,将所载药物传送到肿瘤细胞,从而大大提高药物疗效,减轻毒副作用。抗体CD133、CD90、CD44、OV6、上皮细胞黏附分子(EPCAM)以及CD13等[82,83]与化疗药物制成的脂质体可显著提高药物的靶向性,增强化疗效果。如向荣课题组[84]制备了CD44抗体修饰脂质体纳米粒子并包载抗癌药物阿霉素用于肝癌治疗。结果显示,CD44抗体修饰脂质体可在裸鼠肝脏部位聚集,且具有显著抑制肿瘤生长的效果。
尽管单克隆抗体制剂已经取得理想的成果,多种产品已经上市,但仍然有许多值得解决的问题。如鼠源性抗体应用于人体往往会产生人抗鼠抗体(Human anti-mouse antiBodied, HAMA),从而引起过敏反应,限制鼠源性抗体在临床上的应用[85,86] ;而目前上市的抗体制剂中完全人源化的单抗相对较少,多次重复使用可能引起免疫原性和其它危害;抗体的小型化,抗体及其偶联物均为大分子物质,庞大的分子难以通过毛细管内皮层和细胞外间隙到达实体瘤深部的肿瘤细胞;此外,抗体药物大多昂贵,如利卡汀需要约2.88万元/支,普通病人难以支付等等。
Liu等[90] 以胰岛素为导向配基,米托蒽醌为模型抗肿瘤药物,制备了米托蒽醌-胰岛素偶联物,采用荷瘤肝癌小鼠为肿瘤模型,系统地研究了胰岛素受体介导的肝癌细胞主动靶向给药系统的性质。药物动力学研究结果显示,偶联物具有较高的肿瘤靶向性和较长的血液循环时间。体外药效学评价结果表明,与原料药相比偶联物能更迅速地进入肿瘤细胞并释放药物,并且释放出的药物仍保持抑瘤活性,从而充分保证偶联物的肝靶向抑瘤效果;同时偶联物对正常肝细胞的毒性要明显低于原药,说明其能选择性地杀伤肝癌细胞,降低药物对正常肝细胞的损伤。欧晓红等[91]直接将碘脱氧尿苷修饰到胰岛素(insulin-IUdR)上对肝癌进行靶向治疗,实验结果表明insulin-IUdR与人肝癌细胞同样具有较高的亲和能力,是与邻近正常肝细胞亲和能力的1.45倍。黄娟[92] 以胰岛素为载体,包载5-氟尿嘧啶,制备了胰岛素-5-氟尿嘧啶偶联物,建立了小鼠H22肝癌实体瘤模型,对偶联物在荷瘤小鼠体内分布、药代动力学和偶联物靶向性进行了研究,并与游离5-氟尿嘧啶进行了对比分析,结果显示,偶联物对H22肝癌实体瘤有明显的靶向性,偶联物较原药的抑瘤作用更快,能够发挥5-Fu的抗癌活性作用,能达到肝靶向抗癌药物的要求。
3-型磷脂酰肌醇蛋白聚糖介导
多肽受体介导
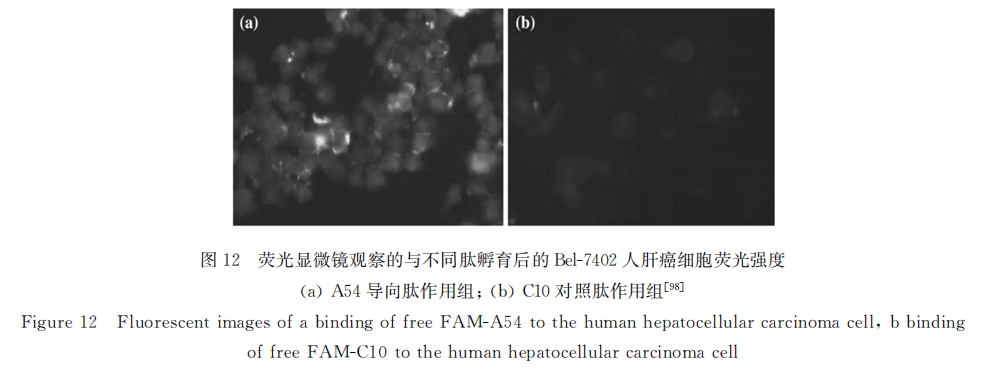
此外,常见的肿瘤细胞靶向配体均可用于肝肿瘤细胞靶向,如叶酸[100]、转铁蛋白[101,102] 以及整合素配体(RGD多肽)[103,104]等介导的均在肝癌检测及治疗领域有着广泛应用,这些内容在Kolhatkar等[105] 的综述中均有详细介绍,在此就不详细赘述了。但我们应该注意到一个问题,在肿瘤细胞表面高表达的受体往往同时存在于其它组织中;而相对正常组织来说,肿瘤组织细胞数量又相对较少,因此其对药物的富集作用有限,大部分药物还是在体内其它器官分布,药物利用率提升有限。如黄娟等研究显示:相对普通5-氟尿嘧啶(5-Fu)胰岛素修饰的5-Fu(Ins-5-Fu)在肿瘤部位的富集程度有很大提升(约提高54.7%),但其在肿瘤部位的量仍仅占注射总量的1%左右。因此作者认为:为了提高药物利用率,首先应赋予药物载体一定器官靶向能力(即药物首先富集于肝脏),在此基础上再利用载体的病变细胞选择性,将药物进一步富集于病变组织,这样才能达到更好的治疗效果。
3 展望
另外我们也应该看到,除脂质体之外目前少有纳米给药体系走入临床使用;而到目前为止仍没有任何一种纳米靶向给药系统进入临床试验。这是多方面原因造成的,比如:(1)目前研究的多数靶向制剂均为静脉注射给药,而此种给药方式对于新材料的血液相容性及生物相容性的要求较高,因此很难获得审批;(2)靶向材料,往往需要将靶向配体通过化学键修饰到有机/高分子材料上,从而增加了材料的制备成本以及产品质量的控制难度;(3)很多肝靶向给药体系的靶向机理及代谢途径仍不清楚,如甘草酸/甘草次酸受体的种类至今仍未确认。这些问题需要材料学家、分子生物学家以及临床医生合作解决。
除此之外,我们还应注意到:理想的肝靶向给药系统不仅应在将药物富集并驻留在肝脏部位,而且应尽可能提高其在病变细胞当中(如肝癌细胞)的浓度,从而减少对正常细胞的伤害。这不仅要求靶向给药系统具有肝靶向能力,还应具备病变细胞识别功能。表3中列举了一些具有病变细胞识别能力的配体,这些配体介导的肝靶向给药系统有望在未来的肝脏疾病治疗中发挥更大的作用。另外,在肝靶向药物递送的基础上赋予载体一定环境敏感功能有可能成为解决这一问题的有效途径。如本组近来研发了兼具肝靶向和酸敏感功能的新型肝靶向给药/释药体系,它不仅可以将抗癌药物阿霉素富集于肝脏,而且可以选择性的在肿瘤部位(PH6.5左右)将药物释放出来,从而减少对正常肝组织(PH7.4左右)的伤害、提高药物安全性及生物利用率。
另外,我们通过对比发现了一个现象:靶向给药系统虽然可以将药物明显富集于肝脏(一般可为对照组的1.5倍左右),然而药物的疗效并未体现出相应的显著变化(IC50值大多变化不大)。我们认为这主要有以下几方面原因:首先是药物的释放速度。相对传统的药物溶液(freedrug)纳米载体中的药物往往需要一定的时间才能完全释放出来,这就使得纳米给药体系在治疗的起始阶段有效药物浓度明显低于药物溶液,从而使得其表观细胞毒性下降。另外,纳米载药体系进入细胞后首先会进入内涵体(PH5~6),药物在此释放后往往会被内涵体中存在的各种高浓度裂解酶分解从而在在表观上显示为药效下降。因此,为了保持药效必须使纳米体系尽快离开内涵体,即内涵体逃逸。此外,除了考虑材料与人体环境的影响之外,我们在设计靶向给药系统时还应注意药理学方面的因素。如紫杉醇可诱导和促进微管蛋白聚合,从而抑制了细胞分裂和增殖,发挥抗肿瘤作用,因此必须将紫杉醇释放到细胞质中才能起到疗效;而阿霉素主要通过嵌入DNA而抑制核酸的合成从而起到治癌功能,因此须将其输送至细胞核才能正常起效,这些都涉及到了更深层次的靶向能力———亚细胞靶向或细胞器靶向。这些有待于分子生物学以及材料学的进一步发展才能有效解决。
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。