
摘要:分裂内含肽通过剪接反应实现多肽片段的连接, 具有高效且无痕的特点, 受到了广泛关注. 本文基于分裂内含肽的结构特征与剪接反应过程, 结合近年来关于分裂内含肽性能优化和应用研究进展进行了综合评述, 揭示其作为一种日渐成熟的蛋白质工程化技术在蛋白质化学合成领域的前景, 并简要分析了目前分裂内含肽工具面临的问题与挑战, 并对可能的解决方案进行了展望.
翻译后修饰极大地丰富了蛋白质的结构与功能的多样性[1]. 这些修饰蛋白在药物开发[2]、 蛋白质组学[3]以及蛋白质结构-功能关系解析[4~8]等方面具有重要的应用. 目前, 翻译后修饰蛋白可以通过天然提取和生物表达等方法获取. 但这些方法仍存在一系列问题, 例如, 天然提取难以获得均一修饰的蛋白样品, 而生物表达获取含多种翻译后修饰的蛋白样品依然存在困难等. 蛋白质化学合成技术是获得翻译后修饰蛋白的一种新兴技术, 该技术基于固相多肽合成技术和多肽片段连接技术. 固相多肽合成技术[9]可以直接将各种非天然氨基酸及带有修饰基团的氨基酸方便地引入多肽链中特定的位点. 尽管固相多肽合成技术的合成能力上限一直在不断提高[10], 但大部分蛋白仍然难以通过固相合成一次性获取. 因此, 使用多肽片段连接技术能够将含特定修饰的多肽片段进行连接, 极大地扩展了蛋白样品的获取范围(图1). 通过多肽片段连接, 研究者们已经合成了带有荧光标记[11], C13和N15等同位素标记[12], 磷酸化、 甲基化及泛素化等翻译后修饰[13], 以及含非天然氨基酸[14]等功能的蛋白质.
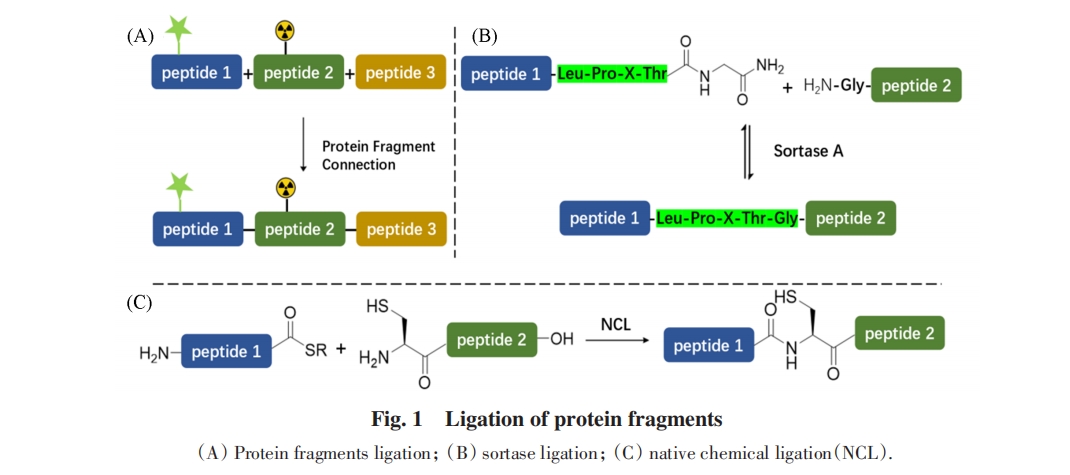
目前, 应用最广泛的化学连接技术是自然化学连接(NCL). 该技术由芝加哥大学的Kent等[15]于1994年提出, 通过一个多肽片段的C-端硫酯与另一个N-端Cys多肽片段的选择性化学反应, 在连接位点处形成天然酰胺键. 早期, C-端硫酯的合成受到稳定性差的困扰;近年来通过酰肼氧化的C-端硫酯原位合成及连接策略极大地促进了这一方法的应用[16~20]. 然而, 由于NCL反应依靠随机碰撞, 其连接效率受底物浓度的制约, NCL通常需要mmol/L级别的底物浓度. 当底物浓度低于1 mmol/L时连接效率低, 使得NCL在脂蛋白、 膜蛋白等难溶蛋白片段连接时产生困难. 为增加NCL在低浓度条件下的反应效率, 研究者们提出了多种解决方案, 主要有:向反应体系加入有机溶剂或者去垢剂以增加片段溶解度[21];在主链上引入可移除的增溶修饰以打破氢键网络、 削弱聚集倾向[22,23];通过DNA-DNA、 蛋白-蛋白/小分子等强相互作用模板辅助片段连接, 使片段连接在近似分子内反应的条件下进行[24]等. 此外, 使用活性更高的硒酯代替硫酯作为酰基供体的方案也能使得反应在更低浓度下进行[25]. 虽然这些策略有助于合成具有挑战性的目标, 但也存在增加安装和移除标签或模板的额外操作、 标签最佳安装位置难以预测及硒酯的稳定性较低等固有问题, 导致这些方法在稳健性和操作便捷性方面存在不足.
另一方面, 化学酶法因其能够在低浓度下高效反应, 在蛋白质合成中也被广泛应用[26~28]. 但这类连接反应通常需要在底物中引入酶特异性识别序列, 这些识别序列在反应后往往会保留在产物蛋白的序列中, 留下序列“疤痕”, 如Sortase A酶的残留序列LPXTG[29]. 虽然可以通过选择目标蛋白质固有存在的酶的识别序列作为连接位点, 但这些情况是极其偶然的;通过高通量筛选技术对Sortase A进行序列进化[30~33], 以及使用预先制备成硫酯的蛋白片段作为连接底物[34]等策略可以减少Sortase A酶的序列依赖性, 并减少反应的可逆性[35], 但要实现完全无痕的片段连接仍然困难.
因此, 寻找一种能够高效连接蛋白片段且连接后无痕的蛋白连接工具, 成为研究者关注的方向. NCL反应和Sortase A酶连接过程中都经历了硫酯和酰基S-N迁移过程;在生命进化过程中, 泛素化酶级联反应等过程中也观察到硫酯中间体和酰基S-N迁移过程[36], 由此可见这是生成新的肽键的一种有效途径. 事实上, 人们已经发现了一类能够通过硫酯中间体和酰基迁移路径实现对蛋白质片段的高效无痕连接的蛋白:内含肽(Intein). 内含肽可以分为顺式内含肽(Cis-intein)与分裂内含肽(Split intein)两大类. 其中, 分裂内含肽可以与需要进行连接的蛋白片段分别相连, 已经在大量蛋白质连接与合成中展现出应用价值, 受到了研究者的广泛关注. 本文主要介绍分裂内含肽作为一种蛋白质合成工具, 结合分裂内含肽在蛋白质合成修饰领域的应用案例, 分析了分裂内含肽相比其它方法的优势, 总结分裂内含肽的发展现状, 并展望了其未来的发展前景.
1 分裂内含肽的发现

1969年, Anfinsen等[40]发现在特定的条件下, 分裂成2个片段的酶能够非共价结合并恢复完整酶的催化功能. 1998年, Perler等[41]将这一思想运用到内含肽的设计改造中. 他们将Psp Pol-1内含肽中的一个肽键切断, 将其分裂为N-端片段(IntN)和C-端片段(IntC), 将2个片段分别表达纯化后在体外共复性, 结果表明2个片段通过非共价作用形成复合物并恢复剪接活性.
1998年, Liu等[49]在Ssp DnaE(蓝藻的DNA聚合酶Ⅲ的催化亚基A)蛋白中鉴定出首个天然的分裂内含肽. DnaE的N-端和C-端部分由2个单独的基因DnaE-N和DnaE-C分别编码. 在大肠杆菌中测试时, 2个分裂内含肽片段通过非共价作用结合形成内含肽复合物. 该复合物不仅具有类似内含肽的序列特征, 而且表现出蛋白质反式剪接活性, 剪接后得到完整的DNA聚合酶Ⅲ亚基A. 这一发现表明, 分裂内含肽是天然存在的. 与人工分裂内含肽相比, 天然分裂内含肽具有可在非变性条件下组装及剪接效率更高等优势.
分裂内含肽可以根据其寄主基因归类为具有遗传同源关系的家族类. 此外, 不同的分裂内含肽在反应过程中中间体存在差异, 也可以据此对分裂内含肽进行类别划分. 在结构上, 内含肽一般呈现多个β片层的结构, 分裂的位点一般在β片层之间的Loop区, 从不同区域断裂的内含肽具有不同的特性, 能够丰富分裂内含肽的应用场景, 因此研究者也根据分裂内含肽的分裂位点对其进行归纳.
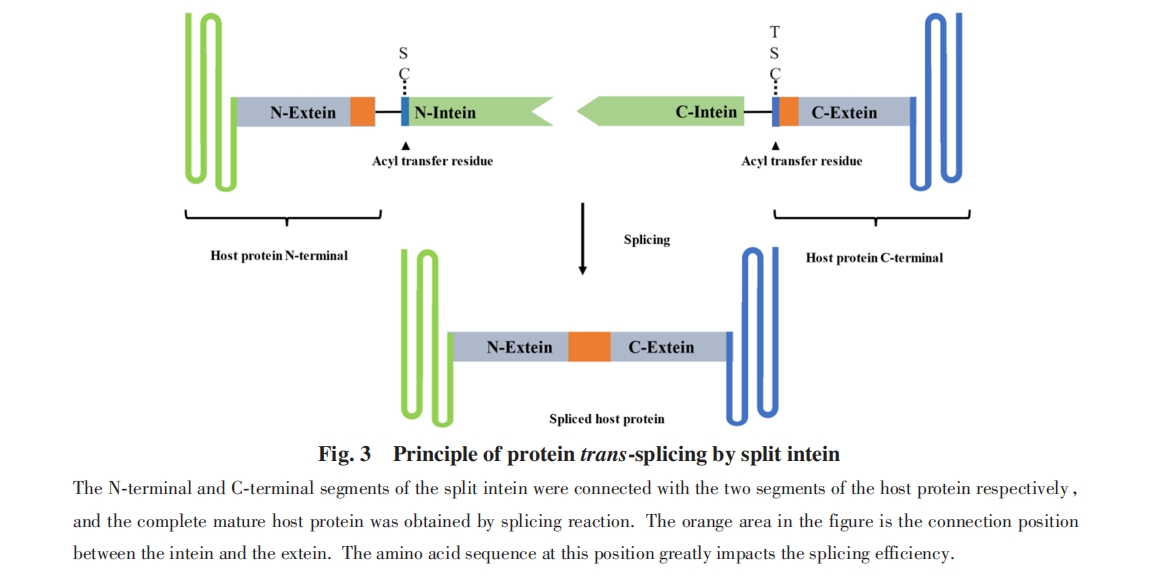
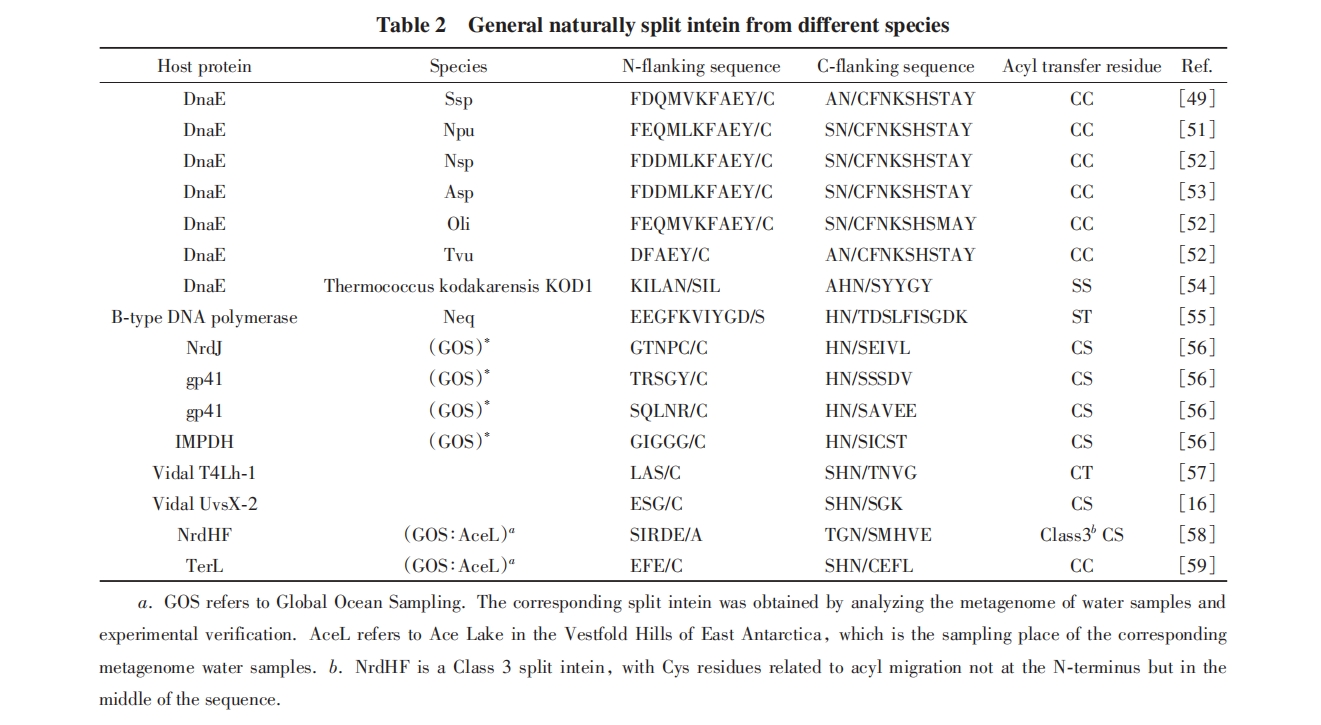
分裂内含肽催化的剪接反应过程涉及多步关键的酰基转移反应, 关键氨基酸残基在这些酰基转移过程中形成硫酯或者氧酯中间体, 对反应性质产生显著影响. 一般而言, 硫酯中间体稳定性较差, 在体外应用中经常观察到中间体硫酯键水解导致的副产物, 而采用氧酯中间体的分裂内含肽则反应速率较慢. 因此研究者根据分裂内含肽1位和C端外显肽+1位的氨基酸, 将其分为CC和CS(T)两类. CC类分裂内含肽(如Ssp DnaE及Sce VMA等)1位和C端外显肽+1位的氨基酸均为半胱氨酸, 反应经历2个硫酯中间体过程. CS(T)类分裂内含肽(如Ssp DnaB, gp41等)1位为半胱氨酸, C端外显肽+1位为丝氨酸或苏氨酸, 反应中经历1个硫酯中间体和1个氧酯中间体过程. 除此两大类外, 还有少数分裂内含肽在反应中经历2个氧酯中间体过程, 如Neq DNA polymerase分裂内含肽[55].
分裂内含肽一般分为2个片段, 2个片段非共价结合后在结构和功能上接近于连续的内含肽. 无论是人工分裂的内含肽还是天然来源的分裂内含肽, 其分裂位点均位于结构上的环区(Loop), 从而避免影响结合和剪接反应活性. 根据分裂位点不同, 内含肽可以被分为S0, S1和S11内含肽[63]. S0内含肽从原始内含肽中归巢核酸内切区域位点切割, 如Ssp DnaE和Npu DnaE等. S1内含肽从接近N端的位置切割, 如Ssp DnaB和M86 DnaB等. S11内含肽从接近C端的位置切割, 如Ssp GyrB S11和Ssp DnaB S11等. 此外, Liu等[63]将DnaB从S1和S0位点分为3段, 依然保留结合及剪接功能.
2 分裂内含肽的反应原理
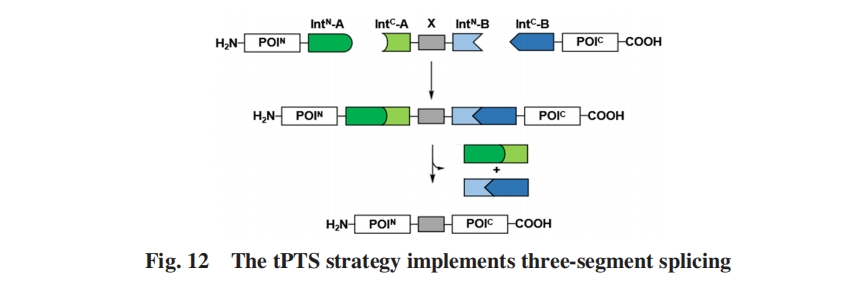
分裂内含肽有多种可能的分裂方式, 多数分裂内含肽分裂成一大一小2个片段, 分裂位点可能在靠近C端的一侧, 也可能在靠近N端的一侧. 其中, 靠近C端的分裂被称为经典(Typical)分裂, 其小片段一般包括中央垂直的一组β折叠和绕平面β折叠的一部分. 靠近N端的分裂被称为非经典(Atypical)分裂, 其小片段一般包括中央垂直的loop和平面一侧ββα motif的一部分. 此外, Liu等[63]通过人工筛选Ssp DnaB可能的分裂位点, 实现了3段分裂内含肽的剪切反应. 已经在Npu DnaE上实现类似的3片段分裂内含肽剪切反应, 说明通过改造得到多于2片段的分裂内含肽是可能的[图4(B)和(C)].
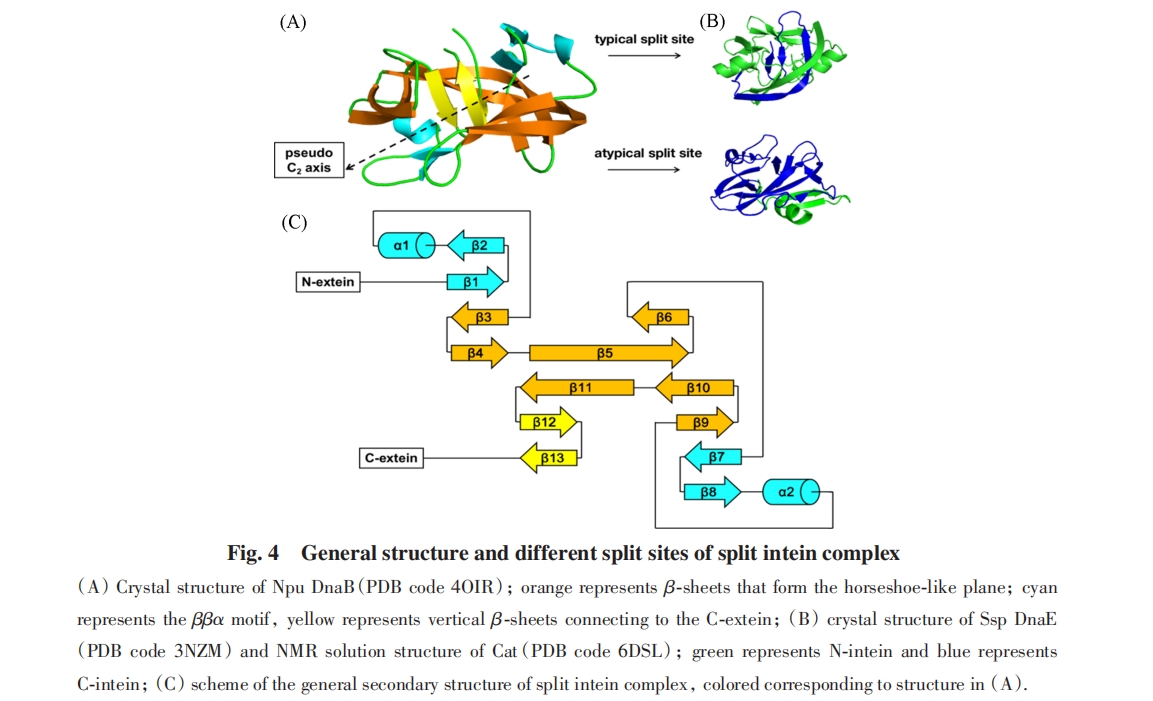
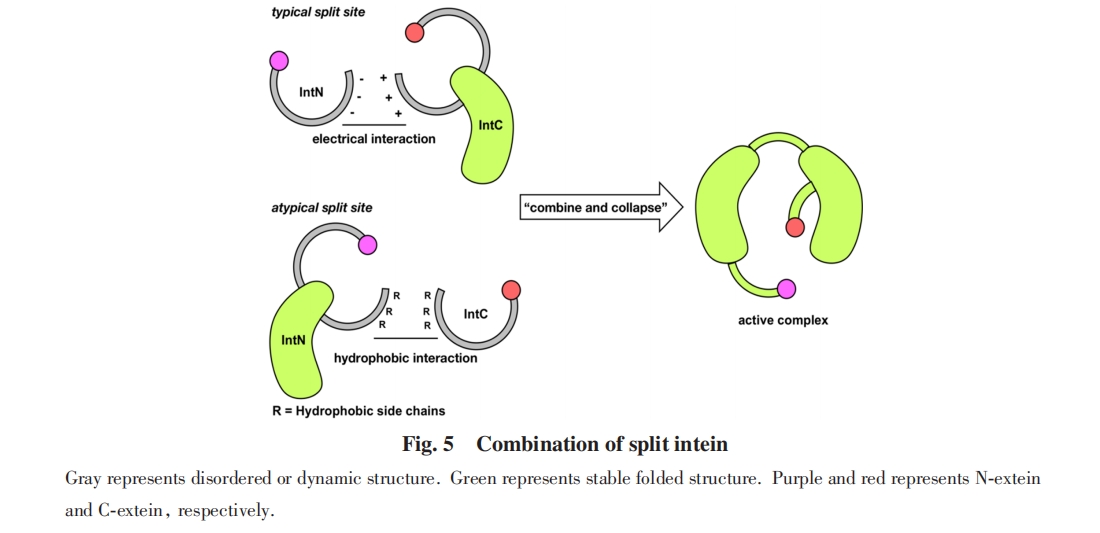
分裂内含肽需要各组分结合后才能折叠成正确的构象. 2013年, Muir等[66]通过核磁共振波谱(NMR)观测了溶液中Npu DnaE分裂内含肽结合前后的构象, 发现分裂内含肽片段结合前, 小片段处于无序状态, 大片段处于构象动态变化的状态. 两片段的相互作用诱导小片段从无序结构折叠为稳定构象, 并诱导大片段形成更加稳定的结构. 类似的NMR信号特征也在Ssp DnaE和Cat两种分裂内含肽上被验证[67,68]. 2018年, Ribó等[64]解析了Neq B-type DNA polymerase1(Neq Pol1) N端大片段和两片段复合物的晶体结构, 发现IntC单独存在的结构与形成复合物后的结构有明显区别. 这些结果说明分裂内含肽各组分无法独立稳定折叠成正确的构象.
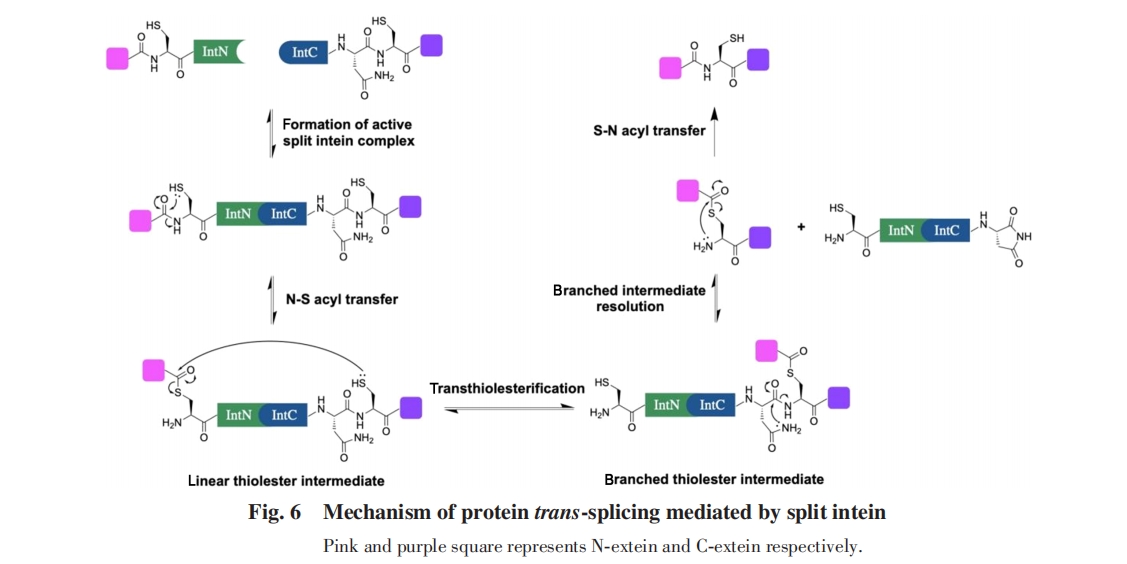
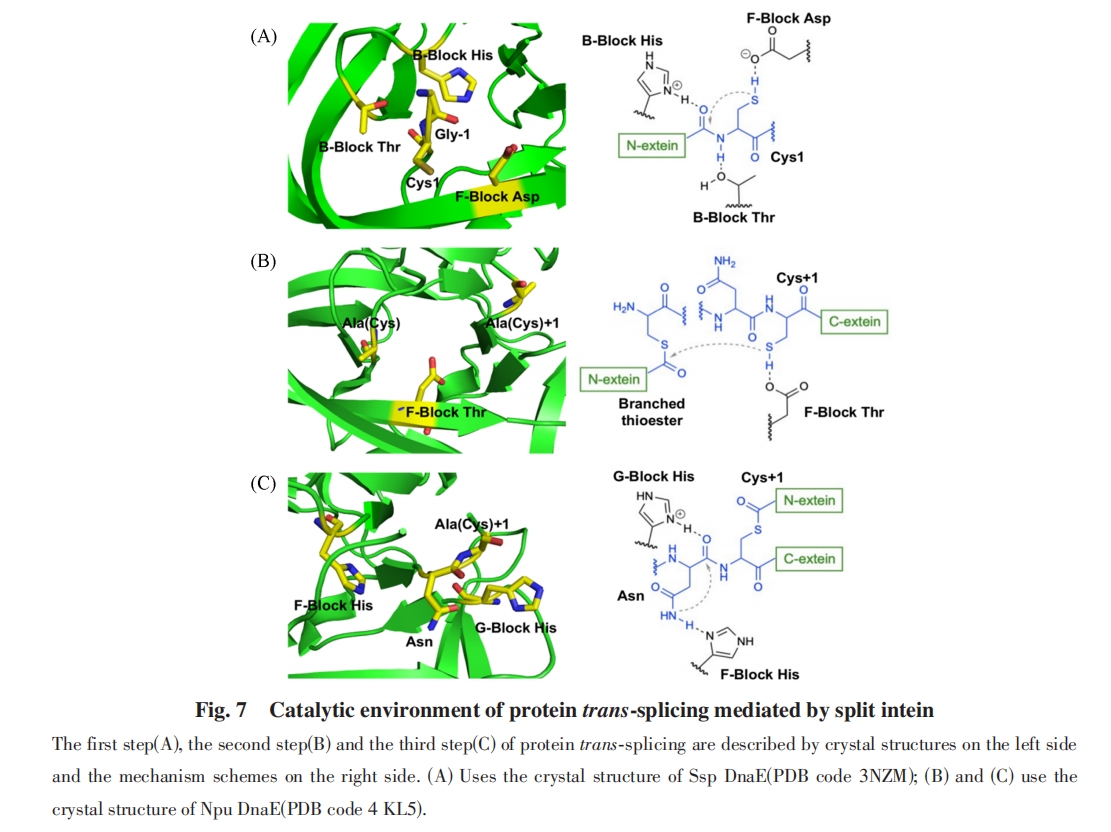
第二步, C-端外显肽的Cys侧链巯基进攻N-端外显肽与N-端内含肽之间的硫酯键, 通过硫酯交换使两段外显肽通过硫酯键相连, 从线性硫酯中间体转化为支链硫酯中间体. QM/MM计算结果表明, F-Block Asp在此过程中同样起到碱催化的作用, 促进了C-端外显肽的Cys的去质子化. 点突变实验表明, 将这个Asp突变为Glu, Asn, Ala或Gly都会显著抑制支链中间体的形成[图7(B)][76].
第三步, C-端内含肽的C-端Asn侧链酰胺进攻C-端内含肽与C-端外显肽之间连接的酰胺键, 形成二酰亚胺五元环, 内含肽与外显肽脱离. F-Block和G-Block中的2个His起到了催化作用. 其中, F-Block His促进了C-端Asn侧链酰胺的去质子化, 起到碱催化作用. 质子化后的G-Block His与酰胺键羰基氧相互作用, 起到了增强羰基亲电性的酸催化作用. 上述相互作用在Ssp DnaB的晶体结构中得到了观测[77], 也得到了计算结果的支持[78]. 此外, Muir等[79]发现对于Npu DnaE内含肽, 在无法形成支链中间体的C1A突变体中, Asn环化速率会降低至突变前的1/200, 说明支链中间体的形成促进了Asn的环化[图7(C)].
最后, 在内含肽从体系中脱离后, 两段外显肽间的硫酯键通过S-N酰基迁移形成天然肽键, 进而得到剪切产物. 该过程不需要其它辅助, 在中性条件下能够自发进行[80].
在一些分裂内含肽中, 上述机理中的Cys被Ser和Thr替代, 反应过程中形成相应的氧酯中间体 (表1和表2). 此外, 部分内含肽第一步剪切的亲核氨基酸位于内含肽内部而不是N端, Mootz等[58]报道了第一个遵循这种机理的天然分裂内含肽NrdHF, NrdHF参与第一步N-S酰基迁移的Cys位于IntC序列的中间部位.
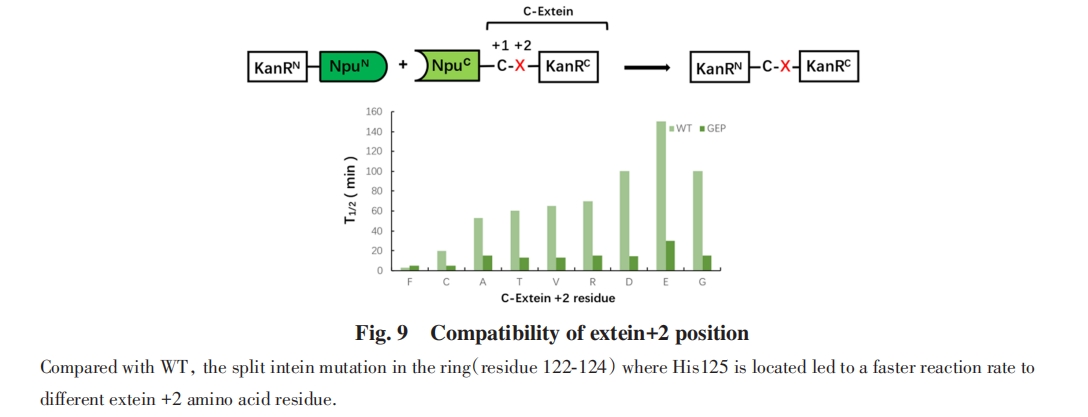
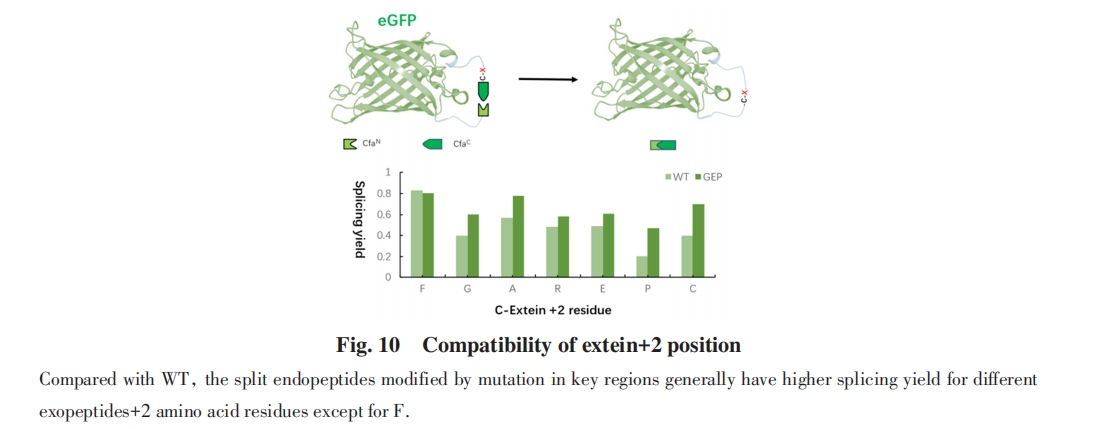
除了内含肽序列内部氨基酸的催化作用, 分裂内含肽还表现出对外显肽序列的敏感性:靠近剪接位点的外显氨基酸突变对反应效率和产率有明显影响, 暗示外显序列可能与关键氨基酸存在相互作用. Muir等[81]将Npu*内含肽(Ssp DnaE-N和Npu DnaE-C的组合)C-端外显肽从天然的CFN改为SGV, 发现C端剪接效率明显下降. 通过定向进化, 得到了可以更有效剪接SGV作为C-端外显肽的mNpu*, 其中包括F-Block D124Y突变. 晶体结构研究显示, C端外显肽CFN中的Phe与促进Asn环化的F-Block His125存在π-π堆叠作用, 使His125处于有利于催化的取向, 而D124Y突变使Tyr代替了Phe的作用, 从而减轻了分裂内含肽对C-端外显肽的敏感性. Mootz等[82]发现将Ssp DnaB N-端外显肽的Gly改变为L-Ala会导致剪接效率明显下降, 而改变为D-Ala的效率下降幅度较小. 通过观察晶体结构, 认为N-外显肽的氨基酸侧链可能与B-Block His侧链产生位阻冲突, 干扰His的催化功能, 而其它朝向的侧链(如D-Ala)产生的位阻冲突较小. 这些实验结果说明外显肽与内含肽之间存在互作, 可能是外显序列敏感性的重要原因.
3 分裂内含肽的工程化改造与性能优化
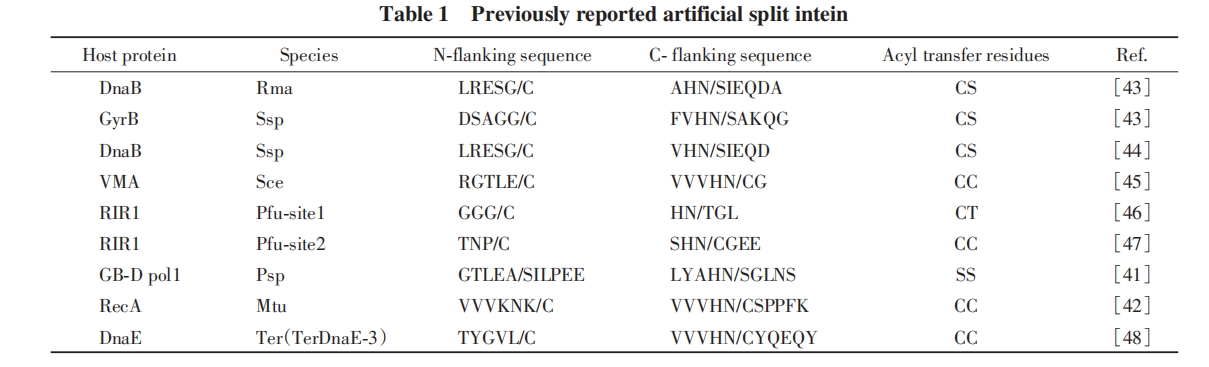
分裂内含肽已经成为一种广泛应用的蛋白质连接工具, 但在其应用过程中依然存在一些挑战, 因此研究者希望能获得具有更优性能的内含肽, 包括剪切活性和稳定性高、 对外显肽剪接位点附近氨基酸序列的耐受性强, 不同分裂内含肽间的反应正交, 分裂内含肽序列短, C-端或N-端长度在固相合成范围内等. 为获得具有上述特性的分裂内含肽, 研究者们进行了广泛的探究与尝试.
2016年, Muir等[83]使用理性设计方法获得了具有强稳定性和高剪切活性的分裂内含肽. 通过分析DnaE家族的Npu(快)和Ssp(慢)分裂内含肽之间剪接效率的差异发现, 大多数关键残基在空间结构上与活性位点直接邻近. 以这些关键氨基酸残基作为对齐位点, 对73个DnaE家族的内含肽进行比对, 最终得到了一个新型分裂内含肽Cfa. Cfa显示出快速的蛋白质剪接活性以及高的热稳定性和变性稳定性. 在30 ℃下, Cfa的剪切速率比此前报道的DnaE家族中最快的Npu DnaE快2.5倍, 其t1/2仅为20 s. 同时, Cfa对变性条件具有很强的耐受性, 在3~4 mol/L Gn·HCl或8 mol/L尿素等强变性体系中都保持良好的剪接活性, 剪接反应平衡常数K>1×10-2 s-1.
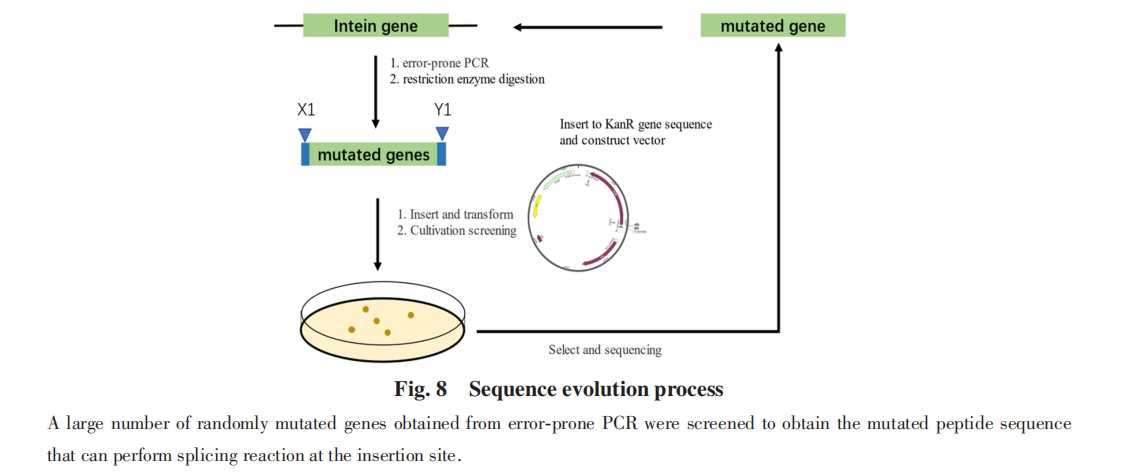

天然断裂的gp41-1内含肽是目前报道的最小的分裂内含肽之一, 具有非常高的反式剪接活性[56], gp41-1内含肽由88个残基的IntN和37个残基的IntC组成. 为了使内含肽对外显肽性质的干扰更小, 人们通常希望使内含肽尽可能小. Iwaï等[86]尝试从gp41-1内含肽的自然分裂位点处截短2个残基, 从而获得更小的分裂内含肽. 然而, 这种缺失使内含肽的蛋白质剪接效率降低了约40%, 作者后续试图优化内含肽的氨基酸序列以恢复截短的gp41-1内含肽的剪接活性到原有水平, 但没有成功. 这表明gp41-1内含肽的大小可能已达到实现功能的最小值.

2014年, Mootz等[59]从宏基因组数据中鉴定并表征了新的分裂内含肽AceL-TerL. 这是首次发现存在天然非典型分裂的内含肽. 只有25个氨基酸的N端片段是迄今为止最短的天然IntN片段, 易于通过固相合成获取. 在8 ℃的低温下, 该内含肽具有最高达90%的蛋白质反式剪接效率. 作者通过定向蛋白质进化选择了进一步改进的突变体. 工程化的内含肽突变体在37 ℃下具有更高的剪接效率, 反应速率常数k>1.8×10-3 s-1, 并在化学标记多种蛋白质应用中展现出天然序列最高50倍的效率.
4 分裂内含肽在蛋白质离体与在体合成中的应用
通过PTS完成半合成的目标蛋白(POI)将被拆分为N端(POIN)与C端(POIC)2个前体片段, 其作为外显肽分别与相应的分裂内含肽片段相连接, 由此组成的融合体片段分别都可以在PTS反应之前单独制备并将所需的修饰引入相应的片段中. 由于许多经过优化的分裂内含肽片段较小, 故含有较小分裂内含肽片段的目标蛋白前体片段(POIN⁃IntN或 IntC⁃POIC)可通过固相多肽合成获得, 从而可以容易地将修饰基团选择性引入目标蛋白的N-端或C-端.
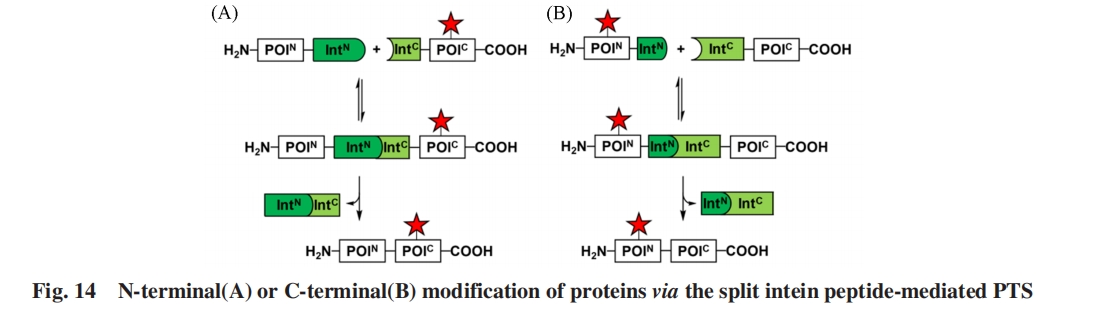
Liu等[93]报道了一种新型工程化S11 Ssp GyrB分裂内含肽. 其分裂位点在C-端附近, 产生长度约150个氨基酸残基的IntN片段和长度仅为6个氨基酸残基的IntC片段, 可用于将合成肽连接到表达蛋白的C端[图14(B)][94]. 这些新颖的包含非常短的N端或C端片段的分裂内含肽显著扩展了其在蛋白质半合成中的应用, 使得将修饰基团添加到目标蛋白的N端或C端更加方便.
利用分裂内含肽还可以实现蛋白质的位点选择性修饰. 为了克服对含有多个半胱氨酸的目标蛋白难以实现选择性修饰的限制, 即在其中一个特定半胱氨酸位点的侧链巯基引入修饰而不影响其余半胱氨酸残基, Mootz等[13]将半胱氨酸修饰与PTS结合使用. 具体来说, 人工分裂的Ssp DnaB和Mxe GyrA的IntC片段的外显肽+1位点分别由丝氨酸或苏氨酸而非半胱氨酸来介导PTS. 将这些分裂内含肽片段与具有单个半胱氨酸的短肽序列(称为CysTag)融合表达, 在该片段中引入荧光团、 生物素及聚乙二醇(PEG)等修饰后, 经PTS获得全长的目标蛋白. 该方法实现了在含有多个半胱氨酸的目标蛋白, 如硫氧还蛋白[13]、 β-内酰胺酶[13]、 人生长激素和非核糖体肽合成酶TycA[95]等蛋白质中的单一半胱氨酸位点的选择性修饰.
近期, Pless等[96]将该策略应用于体内蛋白质修饰, 允许将多种修饰(包括磷酸化、 乙酰化模拟物和非天然氨基酸等)同时引入活的真核细胞中. 通过体内tPTS策略, 在NaV1.5离子通道的胞内域和P2X2受体的胞外域中引入了修饰, 研究了翻译后修饰在离子通道功能以及受体与配体结合中的作用. 正交分裂内含肽介导的串联蛋白反式剪接在体外和体内的蛋白多片段剪接都展现了良好的效果, 有望在蛋白质半合成中得到更多的应用.
在目标蛋白质中引入具有NMR效应的15N及13C等重原子核的同位素标记可看作是上述通过PTS将化学修饰引入蛋白质的一个具体例子, 这一技术最重要的应用是用于核磁共振波谱研究来表征蛋白质的结构和动力学. 然而对于较大蛋白质来说, 全长同位素标记的样品中显著的峰重叠使得核磁共振谱的解析变得困难.
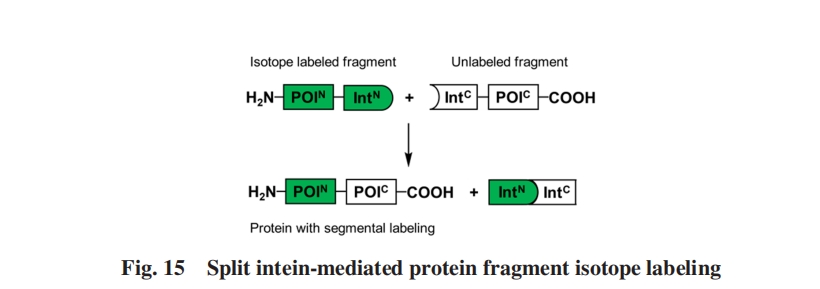
尽管最初标记的目标蛋白质仅有约9000 Da, 但该系统后来成功地用于制备分段同位素标记的麦芽糖结合蛋白(42000 Da)[97]及F0F1ATP酶β亚基(52000 Da)[98], 证明了通过分裂内含肽实现的分段同位素标记可用于更大目标蛋白质的NMR结构分析.
Iwaï等[12]开发了一种通过三片段蛋白质剪接来实现片段同位素标记的新策略. 利用具有相同序列但分裂位点不同的NpuDnaE工程化分裂内含肽, 对来自Lyngbya majuscula的Curacin A(CurA)蛋白通过三片段蛋白剪接来实现部分片段同位素标记. 该蛋白包含3个顺序的酰基载体蛋白(ACP)结构域. 这 3个结构域之间高度的序列同一性(93%~100%)导致其所有3个结构域均被同位素标记的样品的NMR信号严重重叠. 因此, 选择性地对该三结构域蛋白质的中心结构域进行了同位素标记, 通过分裂内含肽介导的PTS, 以约40%的收率获取了用于NMR分析的部分片段同位素标记的全长CurA蛋白. 该方法将部分片段同位素标记策略在核磁共振研究中的应用拓展到了多结构域蛋白中的结构域-结构域相互作用研究.
Iwaï等[99]还开发了将同位素标记的片段与未标记的片段在同一细菌培养物中一次生成, 随后直接发生剪接反应来体内获取分段同位素标记的全长蛋白的策略. 其基本原理是在单个细胞培养过程中的不同时间表达含分裂内含肽的蛋白片段前体, 并在各个表达步骤之间更换未标记或同位素标记条件的培养基. 这样, 只有一种前体蛋白片段是被同位素标记的, 剪接反应后得到的即是只有一个片段被同位素标记的目标蛋白, 实现了分段同位素标记蛋白质的直接体内获取[98].

为此, Benkovic等[2]开发了分裂内含肽介导的多肽和蛋白质环状连接(SICLOPPS)技术. 这项技术可以实现体内的环肽文库构建, 并结合功能筛选, 得到了许多具有生物活性的环肽, 如酪氨酸酶抑制剂pseudostellarin F[2]及甲基转移酶抑制剂等[100].
为了开发可以调控蛋白质-蛋白质相互作用的环肽分子, Benkovic等[103]整合了SICLOPPS与反向双杂交系统(RTHS)2种技术. 在宿主细胞中经SICLOPPS技术产生的环肽文库通过RTHS系统直接进行筛选, 鉴定出了调节FKBP12-雷帕霉素-FRAP相互作用和HIV-1蛋白酶和核糖核苷酸还原酶相互作用的环肽分子, 展示了SICLOPPS技术构建环肽文库并用于获取可调控蛋白质-蛋白质相互作用的环肽的潜力.
另外, 研究者们还开发了将分裂内含肽与连续内含肽联用来构建环肽的方法[104], 以及通过PTS形成肽键完成肽环化后, 再利用半胱氨酸残基形成大环肽内部的二硫键来构建双环肽产物的策略[105], 这体现了分裂内含肽相关方法用于构建环肽类分子的良好效果及广泛应用.
基于分裂内含肽的多肽环化还可与其他新兴筛选技术结合, Park等[106]开发了一种称为CWCPS(Custom-designed warhead-armed cyclic peptide screening)的策略, 将可与靶蛋白活性位点结合的弹头化学基团引入由分裂内含肽介导的PTS生成的环肽抑制剂, 再通过酵母双杂交进行细胞内筛选. 构象稳定的环肽中的弹头化学基团与活性位点结合后的的解离更慢, 亲和力显著增强. 通过该方法发现了一种针对癌症靶点HDAC8有效的抑制剂CY5-6Q, 其表现出很强的结合亲和力(KD=15.1 nmol/L)和抑制作用(IC50=0.61 μmol/L). 这表明基于分裂内含肽的方法是细胞内构建环肽的一个相对稳健的策略, 在有前途的环肽药物前体的发现中发挥作用.

5 总结与展望
经过研究者的持续探索, 分裂内含肽介导的蛋白质反式剪接已经由一种有趣的蛋白质翻译后现象发展成为一种应用广泛的高效连接方法. 对蛋白质反式剪接的化学过程的解析, 使人们更好地理解分裂内含肽结构与功能之间的关系. 快速反式剪接分裂内含肽的发现、 内含肽的序列进化、 内含肽无痕剪接策略的开发、 正交内含肽库的建立等, 都大大改进了基于内含肽的连接技术, 使其成为日渐成熟的蛋白质连接工具, 分裂内含肽介导的蛋白质反式剪接技术的应用已经蓬勃发展. 分裂内含肽系统促进了结构生物学的发展, 特别是核磁共振波谱结构解析中的应用;分裂内含肽系统也促进了合成或半合成更大、 更复杂、 带有多种修饰的蛋白质;此外, 基于分裂内含肽技术的环状肽库也已成为药物发现的有效策略.
然而, 人们也必须认识到目前对分裂内含肽的理解和研究尚不完善. 虽然对于分裂内含肽结合以及后续反应过程已经进行了研究, 但是对于反应过程中更细致的结构变构与催化功能变化的分析还比较粗糙. 更好地理解硫酯交换过程中2个巯基如何靠近, 支链硫酯如何对天冬酰胺环化过程产生促进, 都有助于更好地协调剪接反应的各个步骤的动力学, 从而提高整体的连接效率, 避免C-端或N-端水解副产物的出现. 此外, 目前对分裂内含肽在强变性、 高温、 氧化性等条件下的稳健性研究尚不充足, 可能在与其它化学反应联用时带来不确定性.
随着更多的微生物基因组被测序, 分裂内含肽的数量将迅速增长, 未来有望发现具有独特性质(例如能够耐受高温、 高盐等极端条件)的新型分裂内含肽, 丰富人类对分裂内含肽的认识, 揭示现今尚未认识到的潜力, 为分裂内含肽技术的发展带来新的机遇, 并最终获得通用型内含肽, 能够对任何外显肽序列均具有剪快速接动力学, 产率高, 分裂片段易于通过化学合成技术获取, 且连接活性易于通过外源刺激控制等.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。