
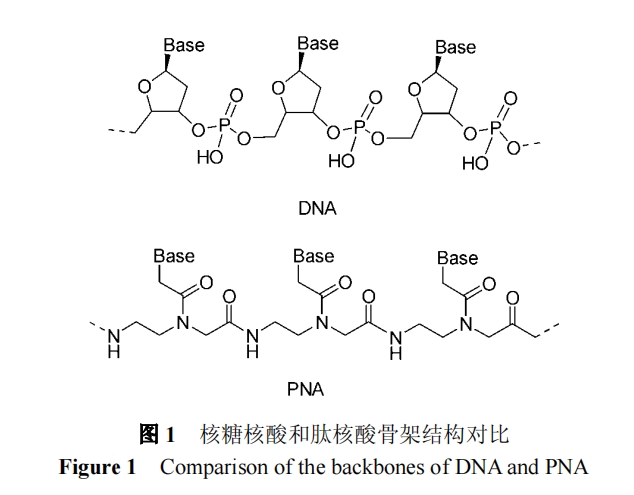
摘要 肽核酸是寡核苷酸模拟物, 它的糖-磷酸骨架被 N-(2-氨基乙基)甘氨酸骨架所代替. 为了优化肽核酸的性质, 各种结构的肽核酸(PNA)单体被合成出来. 综述了肽核酸的合成、结构修饰及应用.
寡核苷酸在治疗用药物、分子生物学研究工具及诊 断试剂上应用广泛. 寡核苷酸应用的主要制约在于它容 易被核酸酶所降解、杂交后热稳定性差以及会与蛋白等 非特异性结合等 . 为改造寡核苷酸的理化和生物学特 性, 许多寡核苷酸类似物被研究出来. 肽核酸是寡核苷 酸模拟物中的较为重要的一种.
1991 年 Nielsen 等[1]报道了用 N-(2-氨基乙基)甘氨 酸骨架代替糖-磷酸酯骨架作为重复结构单元(图 1), 合 成了以肽键连接的寡核苷酸模拟物 , 称为肽核酸 (Peptide nucleic acid, PNA). 尽管 PNA 在结构上相对寡 核苷酸有了显著的改变, 但 PNA 与互补核酸之间的结 合仍遵循碱基互补配对原则[2], 甚至比天然核苷酸具有 更高的亲和性[3], 有较强的抗核酸酶和蛋白水解酶降解 的能力[4] . 科研人员设计合成了各种结构的 PNA, 以优 化其生物学稳定性和利用度、靶结合特性以及药代动力 学特性, 并将 PNA 应用于诊断和治疗等方面, 从而开创 了一个新的研究领域. 本文对 PNA 的合成、修饰和应用进行综述.
1 PNA 单体的合成
各种各样的构建模块被用于合成 PNA 及其类似物,包括骨架结构、在 N-(2-氨基乙基)甘氨酸上连接手性和 非手性的基团、碱基的类型等.
1.1 经典的 PNA 骨架合成
经典的 PNA 的骨架单体是 N-(2-氨基乙基)甘氨酸, 在甘氨酸的氮上连接碱基的衍生物. 通常先合成端基 N 有保护基的氨基乙基甘氨酸酯, 然后再将碱基衍生物连 在未受保护的氮上. 常用的方法有:
1.1.1 烷基化反应
以乙二胺或氨基乙腈为原料, 与卤代乙酸衍生物进 行烷基化反应, 适用的保护基(protect group, PG)有: 芴 甲氧酰基[5] (9-fluorenylmethyloxycarbonyl,Fmoc)、对甲 氧基苯基二苯甲基 [6] (4-methoxyphenyldiphenylmethyl, Mmt)、叔丁氧羰基(tert-butyloxycarbonyl, Boc)[7,8] (图 2).

1.1.2 席夫碱的还原反应
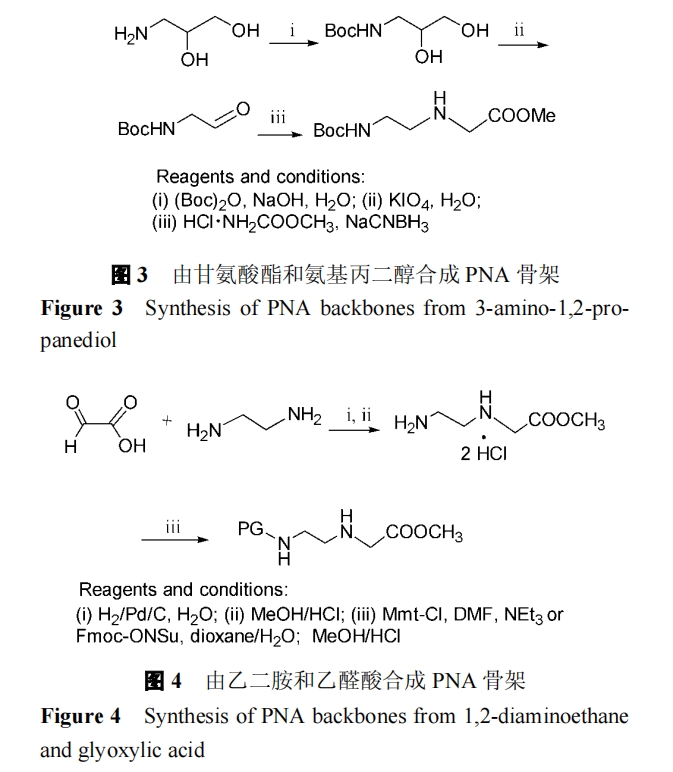
还原甘氨酸酯与保护的氨基乙醛形成的席夫碱[9],虽然只适用于Boc保护基, 但该方法稍加修改即可用于合成各种有侧链的PNA单体[10](图3).
还原乙二胺与乙醛酸形成的席夫碱, 得到N-(2-氨基乙基)甘氨酸, 然后再选择连接适当的保护基, 有Fmoc[11]和Mmt[12]等(图4).
先将甘氨酸还原成Boc氨基乙醛, 再与甘氨酸酯反应[13](图5).
1.1.3 Mitsunobu 反应
利用氨基乙醇与对硝基苯基甲磺酰基(o-NBS)保护 的甘氨酸甲酯进行 Mitsunobu 反应[14](图 6).

1.2 在骨架上引入碱基
四种碱基都是经胺的烷基化反应形成碱基乙酸衍生物, 再采用通常的多肽合成的方法, 联结碱基乙酸和骨架上的未受保护的氮.
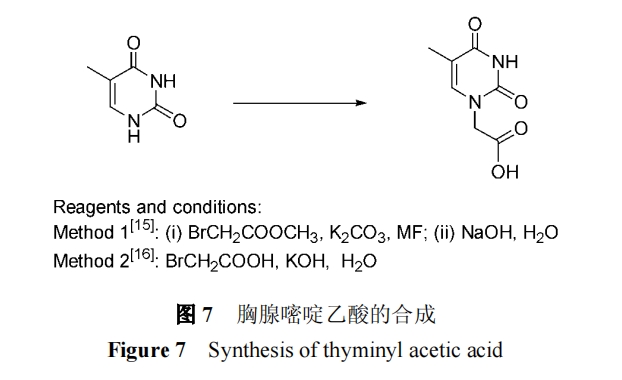
胸腺嘧啶的烷基化反应通常不需要使用保护基团,因此当与溴乙酸酯反应再经皂化[15]或直接与溴乙酸反应[16]即可得胸腺嘧啶乙酸(图7).
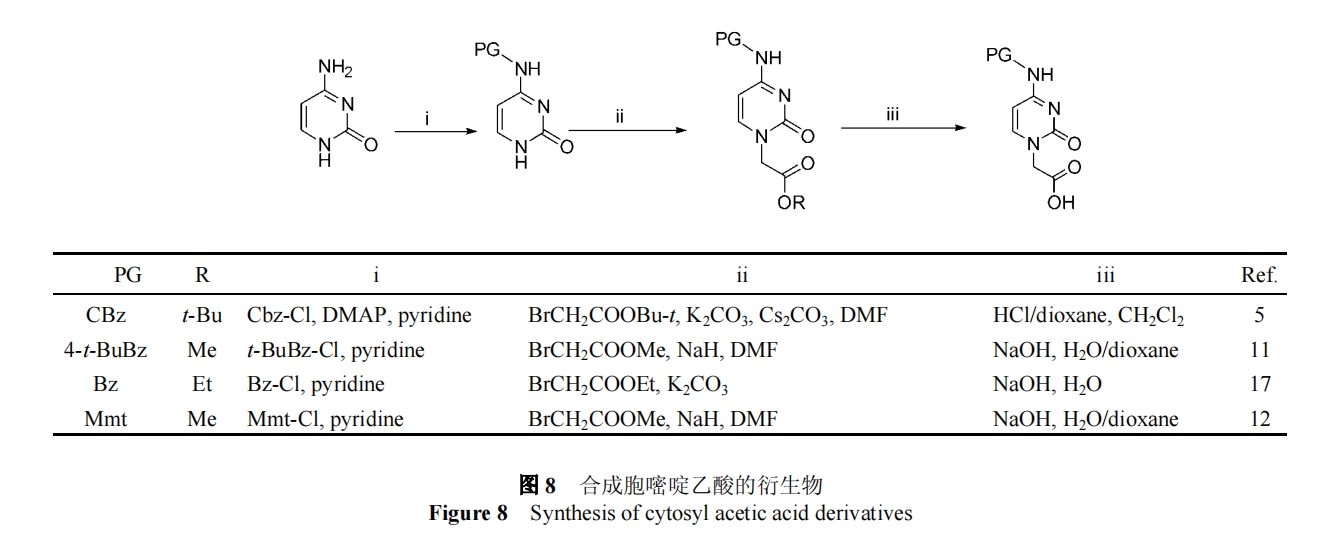
其余三种碱基上都有活泼基团, 需先加以保护.胞嘧啶上的活泼基团为4位上的氨基, 可选择的保护基有: 苄氧羰基(benzyloxycarbonyl,Cbz)[5]、对叔丁基苯甲酰基(4-tert-butylbenzoyl, 4-t-BuBz)[11]、苯甲酰基(benzoyl, Bz)[17]以及Mmt[12]等, 再与溴乙酸酯进行烷基化反应, 然后皂化即得胞嘧啶乙酸的衍生物(图8).
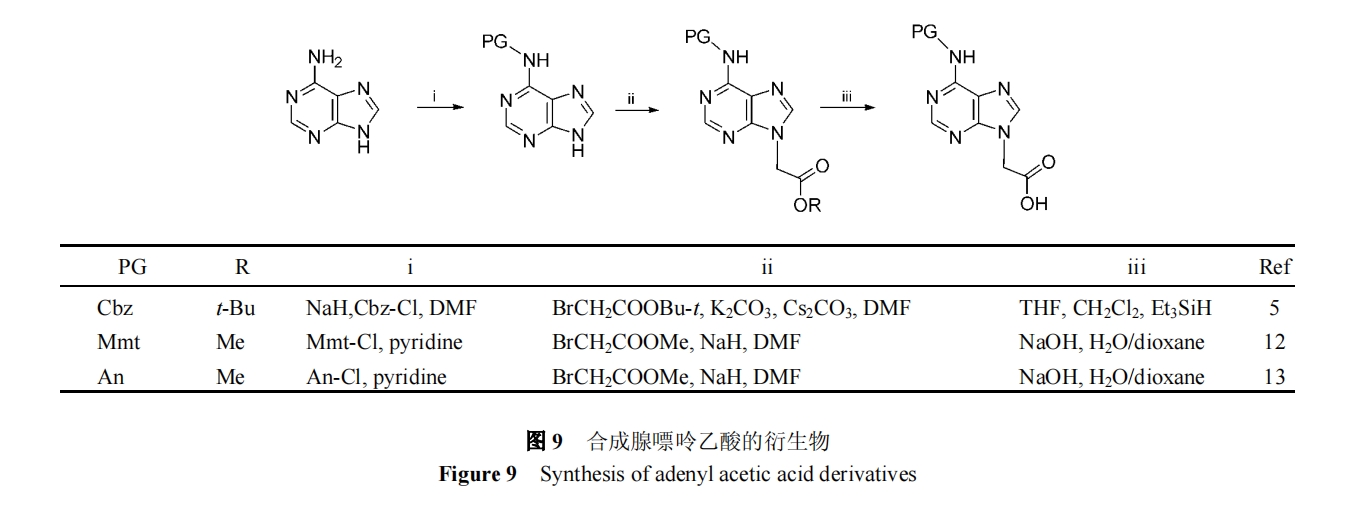
腺嘌呤的保护过程与胞嘧啶基本相同, 可用的保护基有 Cbz[5], Mmt[12], 对甲氧基苯基[13](anisoly,An)(图9).
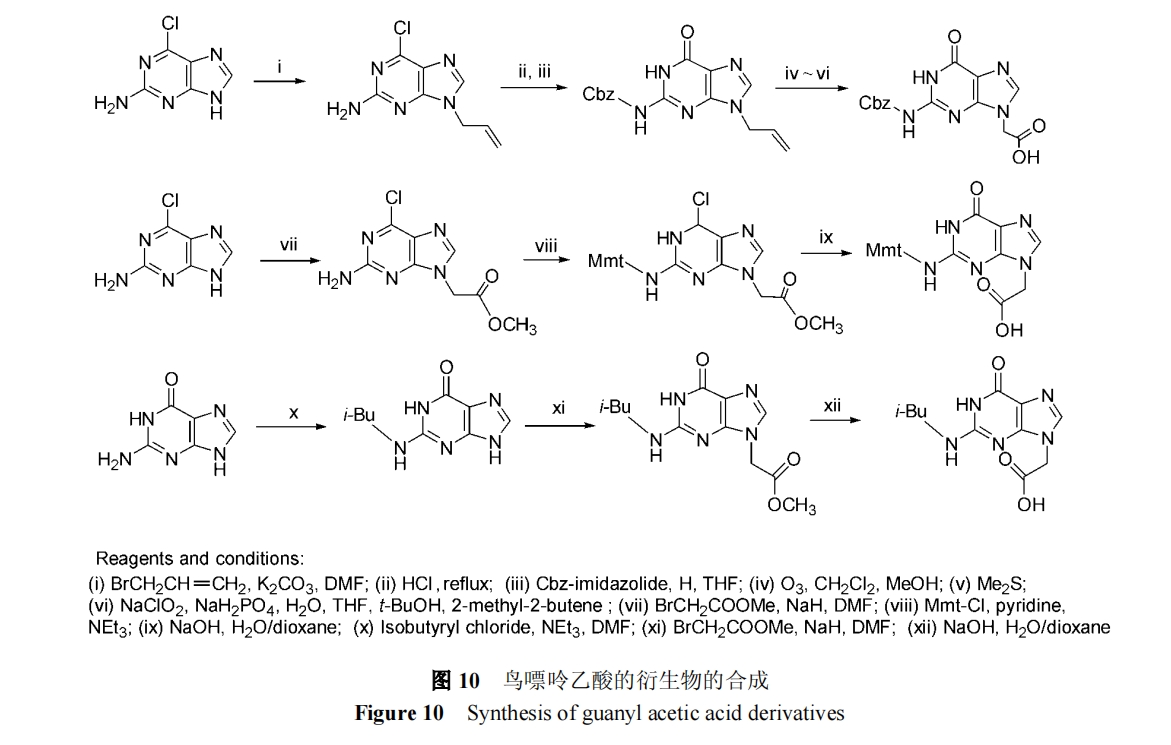
鸟嘌呤的保护比较复杂, 需要在N9 的烷基化的过程中避免N7 烷基化的副反应干扰. 一种常用的方法是在烷基化中用2-氨基-6-氯嘌呤, 烷基化后再在酸性或碱性条件下回流, 将氯水解转化为羰基, 过程如图10a[5], 10b[11]. 或是直接烷基化N2连有保护基的腺嘌呤,色谱分离N7/N9 两种烷基化产物, 然后皂化得鸟嘌呤乙酸的衍生物[12](图10c).
1.3 对经典 PNA 的改造
1.3.1 PNA 骨架的修饰
目前, PNA 合成的研究集中在骨架修饰 PNA 衍生 物上, 是因为用改造和未改造的 PNA 单体, 混合制成骨 架的寡核苷酸类似物对 DNA 和 RNA 有更好的杂交特 性[18], 而且骨架修饰能优化 PNA 的特性, 如水溶性、生 物利用度等. 延长骨架碳链会使 PNA 杂交活性显著降 低[19] . 当前研究较多的有以下几个方面.
1.3.1.1 在骨架上引入支链
引入支链可使单体成为手性分子, 而对杂交性质则 影响很小[20] . 常用几种引入侧链方法包括对经典单体 合成方法的改进 , 利用各种天然 α - 氨基酸 引入支 链[10,20,21,14]、不对称催化氢化反应[22]、Ugi 4CC 反应[23](图 11)等.
前三种方法是对经典 PNA 单体合成方法的改进. 其好处在于可以利用各种天然或非天然氨基酸原料, 原 料易得, 支链结构类型多. 第四种方法由于用到了不对 称催化氢化, 需用光学纯催化剂, 现已不再应用. 第五 种方法是以异腈、 羧酸、胺、醛或酮为原料的多组份缩 合反应. 图 11 给出的仅为其中一例, 四种组份分别为对 叔丁基 -1- 环己烯 基异腈 (4-t-Bu-cyclohex-1-enyl iso- cyande) 、N2-苄氧羰基-N9-羧乙基鸟嘌呤(N2-Z-N2-car- boxymethylguanine)、单叔丁氧羰基乙二胺(mono-Boc- ethylendiamine)、三甲基乙醛(pivalaldehyde). 此合成方法简单, 并可引入某些特殊的支链, 能大大扩展 PNA 的 种类.

1.3.1.2 在骨架上引入环状结构
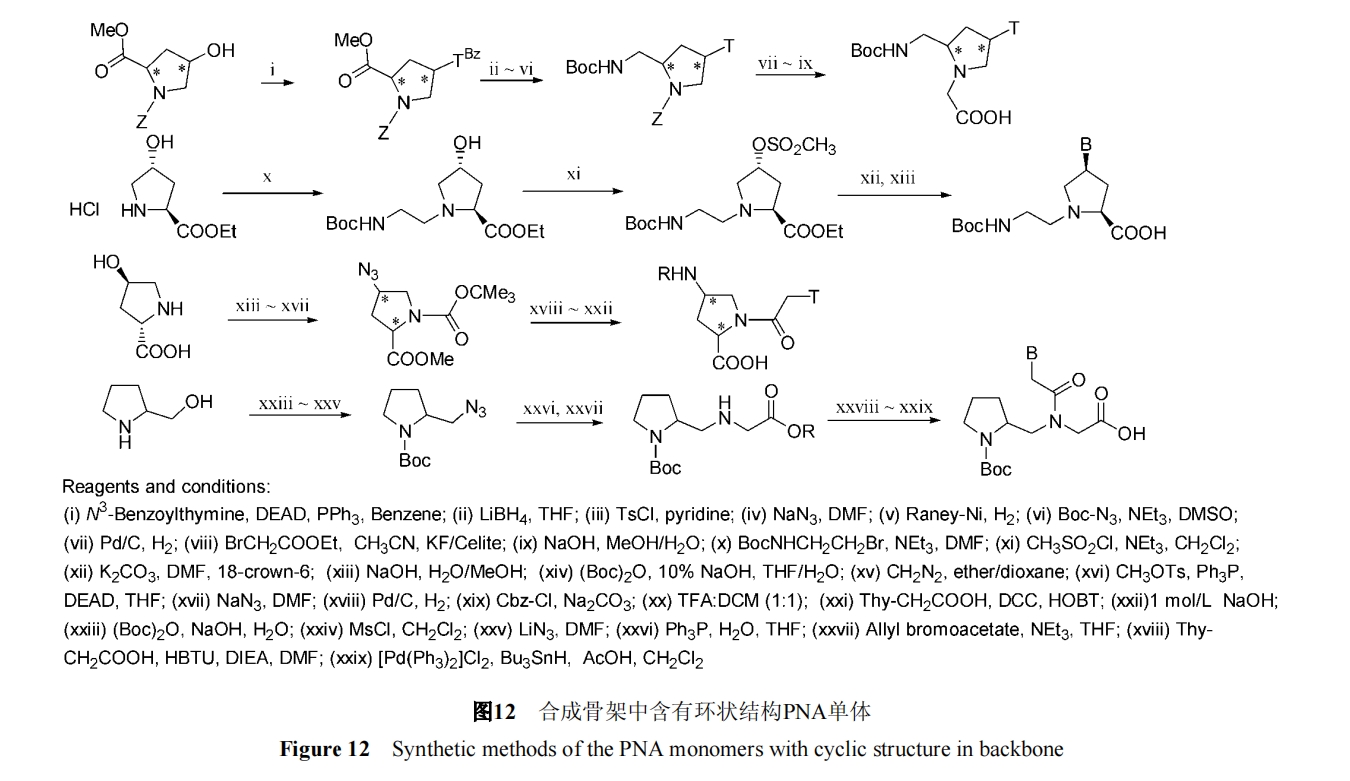
带有环状结构的 PNA 有很多, 其合成过程各异, 脯 氨酸由于其天然结构特点成为研究的主要热点. 以下给 出几个具有代表性的由 4-羟基脯氨酸或四氢吡咯衍生 物制备的骨架含五元环结构的 PNA 单体的合成途径. 图 12[24~27] .
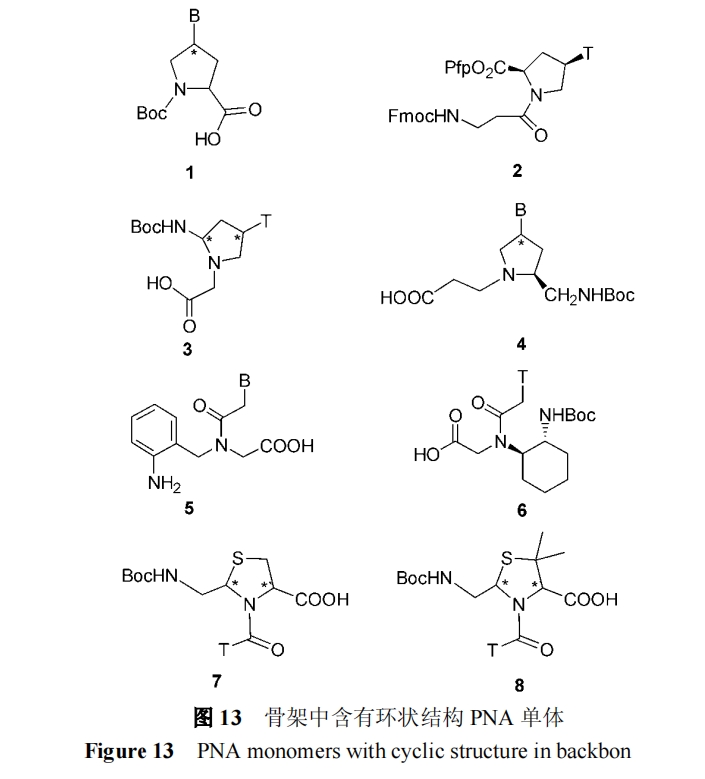
其它带有环状结构的 PNA 单体还有同为五元环的 1[28], 2[29], 3[30], 4[31], 及六元环的 5[32], 6[23] 以及带有硫原 子的 7, 8[33](图 13).
环状结构的引入对 PNA 的性质带来许多新的变化. 如对 3 的研究表明, 其光学异构体对 Tm 的影响是不一致 的. 含有一个(2S,4R)单体的 PNA2 ∶ DNA 的 Tm 值比纯经 典 PNA 单体的 PNA2 ∶ DNA 的 Tm 值提高了 14 ℃ , 而 (2S,4S)则降低了 20 ℃ . 因此, 对于骨架中有环状结构 的 PNA 单体应成为今后研究的一个重点.
1.3.2 改变碱基与骨架的联接位置与方式, 采用非 酰胺键的方式将碱基联于骨架中的碳原子上
文献报道中主要有以下几种连接方式(图14): 碱基与骨架以无羰基的直链C—C键连接9[34]; 以烯键连接10[35]; 以环状结构连接 11[36]. 但由于这种改造方式使得PNA 的结构有很大改变, 有可能会对杂交性质产生较大的负面影响. 如Abdel-Aziz 等对单体 9 的研究发现, 对于12聚的PNA低聚体, 两端用单体9替换其中1~3个经典单体, 只使其与DNA和RNA杂交的Tm值略有降低(△Tm≤10 ℃), 而在低聚体的中间插入一个单体, 就会显著降低Tm值. 单体全部为9 的低聚体, 则没有观察到其与DNA或RNA的杂交.
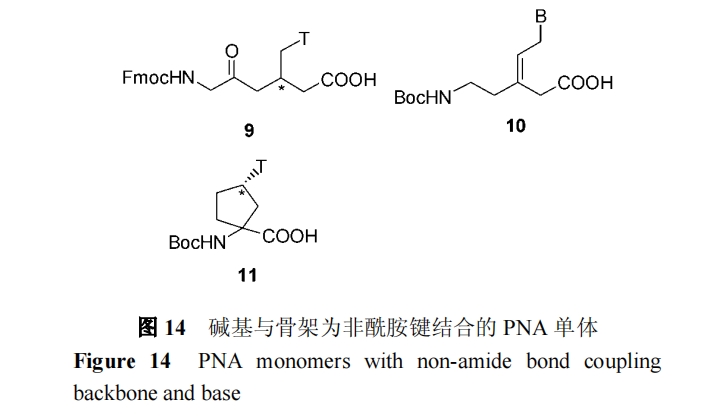
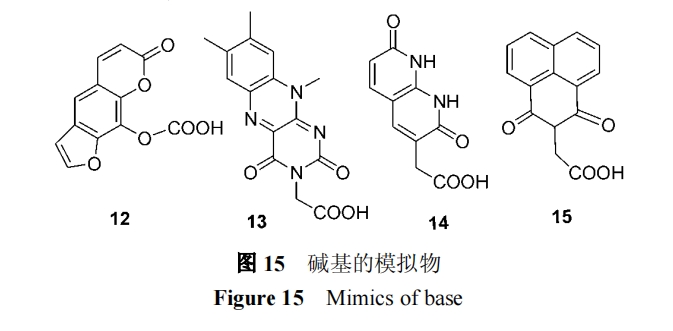
1.3.3 对碱基的替代
图 15 中的 12[37], 13[38], 14[39], 15[40] 已被试验用作碱 基的替代物, 并观察到了与 DNA 的杂交.
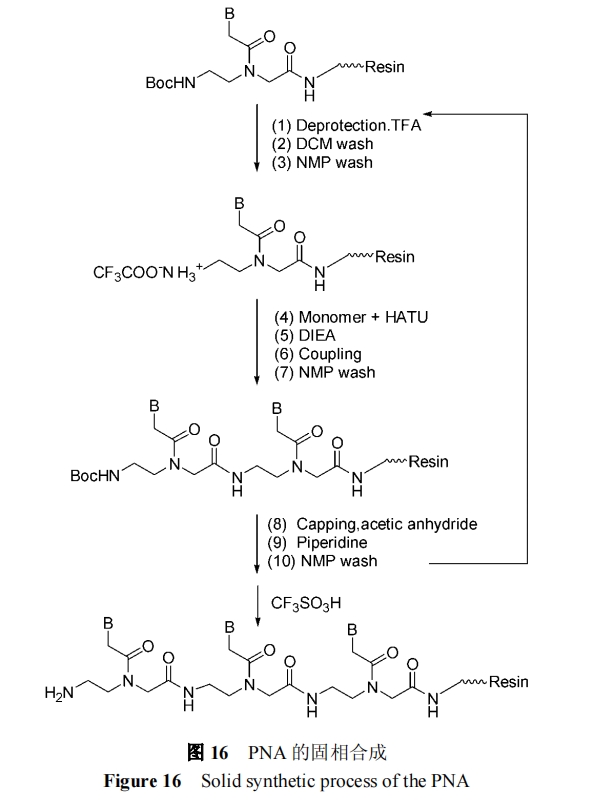
1.4 PNA 低聚体的合成
PNA之间的连接类似于多肽, 因此PNA的合成可采用多肽固相合成技术. 以Boc/Cbz保护策略为例, 其反应过程如图16所示[41.
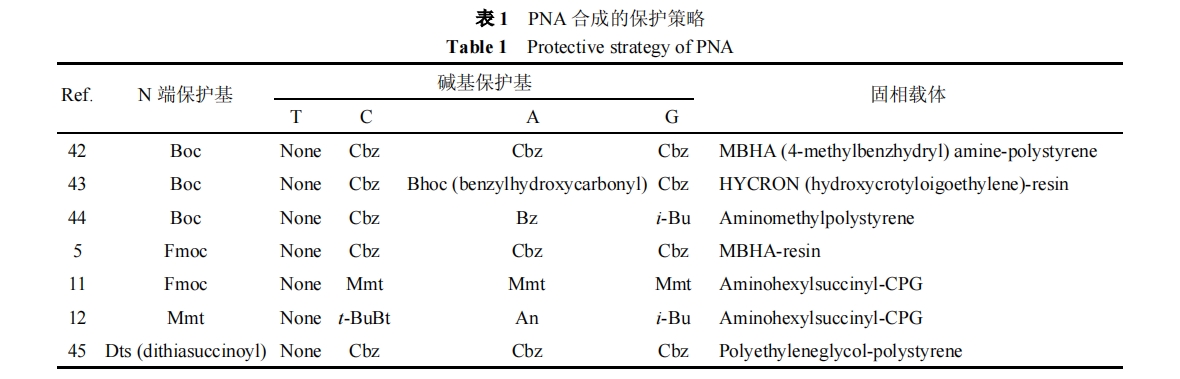
PNA合成中应注意选择合适的N端和碱基保护策略. 虽然PNA单体合成用到的保护基很多, 但由于受到保护和脱除条件及固相合成的限制, 并不是任意两个保护基都能作为PNA单体的N端和碱基保护基对(N端/碱基)的保护策略. 表 1 给出文献中出现的一些保护策略.
2 PNA 的应用
2.1 治疗
从理论上看, PNA有发展为反义药物的可能. 主要因为:(1)PNA不能被核酸酶和蛋白酶降解. (2)与DNA和RNA的结合力强, 特异性高.(3)PNA与RNA结合的稳定性远高于与DNA的结合.(4)PNA与DNA形成的PNA2/DNA三螺旋结构能引起转录停止, PNA与RNA形成的PNA2/RNA能引起翻译停止[46]. 这些特点都是反义寡核苷酸所不具备的.
研究表明, PNA 与 mRNA 结合能有效和特定地抑制 翻译. 寡核苷酸的主要作用方式是通过调控 RNaseH 的 降解作用[47] . 而 PNA 主要依靠位阻影响, 包括结合在 DNA 抑制 RNA 酶的启动和延伸[48] 、结合在 RNA 转录 相关区抑制在转录区的结合和反应[49] 、结合在 RNA 的 非转录 5'区以抑制与核糖体结合或翻译[50] .
由于三链PNA2/DNA和PNA2/RNA结构非常稳定,因此PNA可以作为分子通道阻滞剂用于抑制DNA或RNA的酶反应. 端粒酶是由RNA和蛋白质组成的核糖核酸和蛋白复合物, 负责维持染色体复制后端粒末端长度, 用自身携带RNA 作模板, 通过逆转录合成 DNA.PNA 可与体外的端粒酶中 RNA 有效和特异性的结合[51], 这一特性在通过脂质体将PNA 导入的培养基细胞中也得到了证实[52]. 由于在恶性肿瘤细胞中端粒酶有特别的活性, PNA可作为端粒酶抑制剂, 开发成有效的抗癌药物.
PNA 有抗 HIV 的作用. 研究显示 PNA 可以结合于 逆转录酶的 RNA 模板阻碍逆转录酶的作用[53], 也可与 RNA 结合, 通过抑制 HIV 病毒复制的必要过程——二 聚体的形成, 来阻碍 HIV 的复制[54] .
Tyler 等[55]首先报道了仅通过腹腔注射, 非修饰的 PNA 就能够阻碍注射进大脑的神经紧张素的作用, 表 明 PNA 可能穿过了血脑屏障. 其后, 另一个研究小组的 Bonnard 等[56]通过鼠腹腔注射抗阿片神经肽 FF (NPFF) 的 mRNA 的反义 PNA(三次, 10 mg/kg), 观察到明显的 抑制抗阿片神经肽 FF (NPFF)的作用. 显示 PNA 穿透了 血脑屏障与 NPFF 的 mRNA 结合. Adlerzc 等[58]对培养的 鼠小脑粒细胞和皮质星形胶质细胞体外研究发现, 未修 饰 PNA 能大大下调阿耳茨海默病的一个致病因素—— 淀粉状前体蛋白(amyloid precursor protein, APP). 以上的研究表明, PNA 会在治疗中枢神经系统的基因相关病 症和研究中发挥重要作用.
三链结构的高稳定性也使 PNA 可用于在细胞内修 复突变的 DNA. Faruqi 等[58]报道了 PNA 能被吸收入鼠 体内, 结合于基因靶点, 会导致点突变、单碱基缺失或 插入, 其浓度只需要 10-7 mol/L. 此外, 由于将 PNA 连 于质粒的特定部位, 不会影响质粒的正常生理功能, 因 此 PNA 也可以作为药物载体, 在其骨架上连接肽、蛋 白、药物用于基因治疗.
2.2 诊断
PNA的特性能够解释它在DNA诊断上的应用. (1)PNA 的碱基序列鉴别力和稳定性都好于寡核苷酸. (2)PNA能够以链侵占的方式识别双链DNA.(3)PNA与互补核酸的结合极大地改变了电泳迁移率. 因此PNA 能够作为诊断探针用于检测基因突变和错配分析.
利用碱基完全相配的DNA和不全相配DNA与互补PNA在结合条件上的不同, 通过控制杂交条件, 电泳能够检测到两者的差异[59]. 该方法适用于筛选基因突变样品.Igloi[60]将PNA固定于凝胶中, 在电泳中PNA会对互补寡核苷酸产生阻滞作用, 并且能在电泳中进行特异性杂交. 这种方法能实时显示PNA与互补DNA之间的杂交情况.
使用 PCR Clamping 方法可以分析点突变部位[61]. 靶核酸 PCR 扩增是检测基因突变的一个重要步骤. PNA 与 DNA 的结合不能被 DNA 聚合酶识别, 链不能延伸, 扩增不能进行. 相反其突变型则可以很好地扩增. 使用 这一技术可以精确的证实点突变位置.
一种称为荧光原位杂交(FISH)测定的方法和 PNA 探针技术结合, 已被用于癌症和衰老研究. PNA 探针与 DNA 探针联合, 用于分析 X-ray 导致的染色体互换[62,63], 以及用于染色体异常诊断[64] . PNA-FISH 也被用于医学 诊断和环境样品中检测和鉴定细菌[65,66], 这种检测非常 快速和灵敏, 但不能区分存活的和死亡的细菌.
2.3 分子生物学工具
除了上面提到的一些实验技术,PNA还可用在分子生物学的许多方面. PNA 可以稳定和序列特异性地与dsDNA 形成三链的侵占结合, 因此 PNA 能标记质粒DNA 载体[67]、靶标肽[68]等. 这种标记方法是不可逆的,但却是非共价键结合和“生物学沉默”的标记方法.
在PCR 扩增过程中, 加入一端连有荧光信号基团的特定序列PNA, 与DNA靶分子杂交, 通过检测扩增过程中随着温度变化, 杂交而改变的荧光强度, 可对 PCR过程进行监测[69,70].
3 存在的主要问题与进展
现在, PNA 已经成为一种非常有用分子生物学工 具, 但要成为一种基因治疗药物, 遇到很多障碍. 例如: 水溶性差、细胞膜通透性低、PNA/RNA 不能激活 RNase H、与靶序列结合无方向性等. 由于这些原因, 许多公司 和研究小组中断了对 PNA 的研究. 但是仍有许多研究 小组坚持不懈地对 PNA 进行研究, 取得一些进展, 部分 地解决了这些问题.
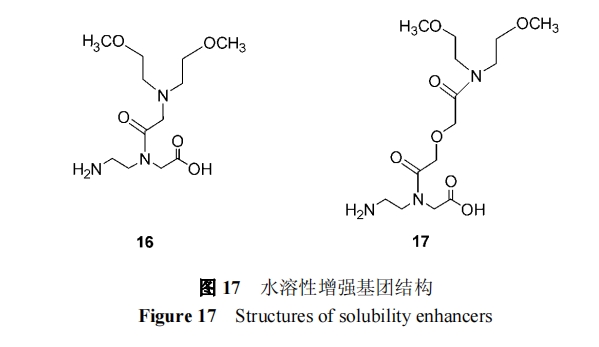
由于 PNA 是电中性化合物且有自聚集的趋势, 因 此它的水溶性很差[71], 并会随着链的增长和嘌呤与嘧 啶比的增高而降低[72] . 在 PNA 的 C 端引入赖氨酸[71]和 在骨架上引入手性极性基团[20]都能提高 PNA 的水溶性. Gildea 等[73]合成化合物 16, 17(图 17), 连于 PNA 的 N 端, 也大大增加了 PNA 的水溶性.
寡核苷酸的反义作用是通过激活 RNase H 来实现 的, 而 PNA 的反义作用来自于立体阻断. 但 PNA 和 DNA 的嵌合物却能激活 RNase H[79]. PNA 的存在可提高 生物稳定性和杂交的亲和力, 而 DNA 则能提高水溶性 和透膜能力.
PNA 可以平行[3]或反平行[79] 的方式与 DNA 和RNA 杂交, 这有可能降低结合的特异性. 最初的研究希望通 过引入手性基团改变 PNA 的这一特性[21] . 但结果显示, 手性中心的引入只能略有改善而不完全解决这一问题. 其后, 研究人员对骨架带有环状结构的 PNA 进行了研 究, 结合的方向性识别仍只是有所改善[31] .
经过十几年的发展, PNA 正逐渐走向成熟. 2002 年, ISIS 公司购买了 PNA 的相关专利, 准备将其发展为第 三代反义寡核苷酸, 这标志着 PNA 成为药物的前景已 逐渐被看好. 改进 PNA 的特性, 满足 PNA 成为药物的 需求, 仍将是今后 PNA 的研究重点.
4 结论
现在, 肽核酸能与DNA和RNA特异性结合及化学和生物学稳定性等特性使其在分子生物学领域得到了广泛的应用, 也带动与之相关的化学、分子生物学和生物技术领域的发展. 但PNA能够成为基因治疗药物, 仍有待于在细胞对PNA 的利用效果和安全性评价方面取得更大的进展. 为此, 不同结构的PNA单体相继被合成出来, 考察其各种低聚体和嵌合体的生物学特性, 以期得到具有更好的生物利用度和药代动力学特性的PNA,我们期待着第一种真正的PNA基因治疗药物的出现.
免责声明:本文为行业交流学习,版权归原作者及原杂志所有,如有侵权,可联系删除。文章标注有作者及文章出处,如需阅读原文及参考文献,可阅读原杂志。